|
|
|
|
ПРАКТИЧЕСКОЕ
РУКОВОДСТВО ПО АНЕСТЕЗИОЛОГИИ
Под редакцией профессора В.В.
Лихеанцева
Медицинское
информационное агентство
Москва
1998
УДК 616—089.5 ББК 54.5 П69
П69 Практическое руководство по анестезиологии /Под ред. В.В. Лихванцева. —
М.: Медицинское информационное агентство, 1998.
— 288 с.: ил.
ISBN 5—89481—022—1
В книге приведены современные
данные о тактике, технике и возможных осложнениях различных вариантов
анестезии. Представлены также фармакокинетика и
фармакодинамика лекарственных препаратов, применяемых в современной
анестезиологии.
В отдельные главы вынесены
проблемные вопросы боли и качества оценки глубины анестезии.
Книга представляет интерес как для начинающих, так и для опытных
анестезиологов, а также для врачей всех специальностей, связанных с хирургией.
УДК 616—089.5 ББК 54.5
© Лихванцев В.В., 1998
© Оформление ООО «Медицинское информационное агентство», 1998
Все права защищены. Никакая
часть данной книги не может быть воспроизведена в какой бы то ни было форме
без письменного разрешения вла-ISBN 5—89481—022—1 дельцов авторских прав
ВВЕДЕНИЕ
Долгие годы анестезиологи
нашей страны были лишены возможности общения со своими зарубежными коллегами.
Мы были вынуждены работать только на отечественной аппаратуре, пользоваться
только отечественными препаратами и применять только те методики анестезии,
которые были нам доступны. Это не могло не привести к созданию особой школы
анестезиологов, адепты которой умели при минимуме возможностей обеспечить
достаточно эффективный и безопасный уровень анестезии. В то же время появление
ряда действительно новых, прогрессивных методов анестезии совершенно
несправедливо прошло у нас незамеченным. Хотя бы в малой степени восполнить этот пробел и призвано настоящее
руководство.
По-видимому, именно ограниченный
арсенал сил и средств привел и к гипертрофированной
оценке роли каждого врача в процессе лечения пациента. Выражения типа: «Каждому больному свое лечение», что
применительно к анестезиологии, звучало как «Каждому больному — свой наркоз»,—
повторялись как аксиома и давали врачу возможность как
для поиска неординарных решений, так и служили оправданием многочисленных
ошибок и промахов. Анестезиология —
наука, которая как ни одна другая медицинская специальность способна оперировать
языком математики, требует, на наш взгляд, пересмотра и таких «незыблемых»
положений, как роль инструментальных и лабораторных методов исследования в
оценке состояния больного. Так, очевидно, что, имея в руках данные
современного ультразвукового, электрокардиографического исследований, результаты
различных тестов и проб, биохимический профиль, врач-анестезиолог вправе и,
более того, обязан правильно оценить состояние больного, сделать оправданный
выбор в пользу того или иного метода анестезии и отвечать за проводимые мероприятия.
Одним из реальных
результатов реформ последних лет стало появление на отечественном рынке
наркозно-дыхательных аппаратов, мониторов и фармацевтических препаратов ведущих
мировых компаний. Однако в русскоязычной литературе весьма скупо изложены возможности
и правила работы с данным оборудованием.
Кроме того, широкое
внедрение «Протоколов» проведения анестезии за рубежом позволило в значительной
мере нивелировать различия в качестве анестезиологического пособия и привело
к появлению «среднего» специалиста-анестезиолога. Данное определение отнюдь не
унижает достоинства врача, а лишь констатирует положение, по которому качество
анестезиологического пособия и его общие принципы определяются стандартом
клиники, а не произволом конкретного специалиста. Врач вправе отступить от
«Протокола», но у него должны быть для этого достаточно веские причины. Если
вдуматься, то это есть не что иное, как специфическое понимание так близких нам
по духу «врачебных школ».
Таким образом, одной из
причин появления настоящего руководства стало стремление поделиться с
читателем собственным многолетним опытом работы на современном (с более
широкими возможностями) оборудовании и с современньми препаратами для общей
анестезии. Другой причиной явилось стремление вынести на суд читателей
некоторые «Протоколы» проведения анестезии, которые приняты в Институте
хирургии им. А.В. Вишневского РАМН.
Поскольку руководство написано в основном коллективом отделения анестезиологии Института, оно и отражает современное понимание проблем анестезиологии именно этим коллективом. В тех местах, где мнение авторов расходится с общепринятым или существует несколько равноправных точек зрения на одну и ту же проблему, авторы сочли своим долгом привести весь известный им спектр мнений, обозначив их основных адептов. Более подробно познакомиться с мнением того или иного ученого можно, обратившись к списку рекомендуемой литературы, приведенному в конце дискуссионных глав.
Последние две главы
руководства полностью основаны на результатах работы, проведенной в Институте
хирургии. Несмотря на то, что по стилю они явно выделяются из книги в целом, мы сочли
возможным включить их в настоящее издание, так как они важны для понимания
позиции авторов по ключевым вопросам анестезиологии.
Руководство не претендует на
исчерпывающее изложение материала, так как не содержит ряда разделов,
посвященных проблемам, которые в силу тех или иных причин не получили должного
развития в Институте хирургии, например регионарная анестезия. Тем не менее,
хочется надеяться, что оно будет полезно как начинающему специалисту, так и
анестезиологу с большим стажем.
Руководство предполагает, что
читатель знаком с основами анестезиологии.
Руководитель отделения
анестезиологии Института хирургии им. А.В. Вишневского РАМН, доктор медицинских
наук, профессор В. В. Лихванцев.
Глава 1
ПРЕДОПЕРАЦИОННАЯ ПОДГОТОВКА
В. В. Лихванцев
Основная
задача анестезиолога на пооперационном этапе — свести к минимуму риск
предстоящего хирургического вмешательства и общей анестезии. Для этого необходимо
выявить особенности пациента, влияющие или способные повлиять на течение
интраоперационного периода. Анестезиолог активно участвует в формировании плана
обследования больного, назначая те или иные анализы, дополнительные
исследования и при необходимости приглашая на помощь консультантов. Он дает
заключение о готовности больного к операции, выбирает метод анестезии и
назначает премедикацию.
Анестезиолог обязан осмотреть
больного минимум дважды:
— при поступлении (или в
начале предоперационной подготовки) — с целью назначения плана обследования
больного и коррекции имеющихся нарушений;
— перед операцией — для
решения вопроса о степени подготовленности пациента к операции, окончательного
определения его физического статуса и плана ведения анестезии.
ОСМОТР
АНЕСТЕЗИОЛОГА
Беседа
с больным и сбор анамнеза
В ходе первичного осмотра
анестезиологу необходимо решить следующие задачи:
— определить физический
статус больного и степень компенсации жизненно важных
функции. При этом следует опираться как на сведения, полученные в
результате беседы с больным, так и на впечатления лиц, постоянно с ним
контактирующих: родственников, врачей и медицинских сестер хирургического
отделения. Упор только на физикальные методы исследования может подчас привести
к ложным заключениям о переносимости операции, и только беседа «с глазу на
глаз» помогает опытному анестезиологу почувствовать ту трудноопределимую
грань, когда операция возможна и осуществима, а когда — бесполезна и, более
того, опасна. Вместе с тем игнорирование данных, полученных в результате
проведения инструментальных исследований, на наш взгляд, гораздо чаще приводит
к ошибочным заключениям, чем принято думать;
— установить
психологический контакт с пациентом. Необходимо внушить ему уверенность в
исходе предстоящей операции, основанную на знании больным характера и
возможных последствий анестезии, вере в профессионализм врача, понимании, что
медицинский персонал сделает все возможное для обеспечения безопасности
вьшолнения операции и создания максимально комфортных условий до, во время и
после вмешательства. Очень важно добиться от больного желания сотрудничать,
ибо только совместными усилиями медицинского персонала и пациента можно достичь
наилучших результатов лечения;
— установить объем
обследования и тактику предоперационной подготовки. При этом в равной
степени следует избегать торопливости и излишнего упования на то, что «все проблемы
не предусмотреть и основная работа все равно предстоит в операционной», и
стремления провести весь комплекс исследований, возможный для данной клиники,
с целью застраховаться от упреков в недооценке тяжести состояния пациента.
Последнее нецелесообразно и из соображений стоимости обследования, о чем нам чем дальше, тем больше придется думать. По-видимому,
следует стремиться к такому объему исследований и консультаций, после которого
можно сказать: «Я знаю о больном все, что необходимо. Дальнейшее обследование
не даст новых, а только подтвердит имеющиеся
результаты. Больной находится на пике возможной компенсации, и дальнейшая
задержка операции не приведет к снижению риска вмешательства»;
— накануне операции:
убедиться в полноте проведенного обследования и лечения. Окончательно
определить риск предстоящего вмешательства, план проведения анестезиологического
пособия, назначить премедикацию.
Анамнез заболевания. При сборе анамнеза
необходимо выяснить время появления первых симптомов болезни и скорость ее
прогрессирования, предварительный диагноз. Установить проводимое лечение и его
эффективность. Выявить степень нарушения кислотно-основного состояния и
водно-электролитного баланса. На основании полученных данных определить
возможный срок предоперационной подготовки.
Сопутствующие заболевания. Прежде всего
необходимо обратить внимание на состояние сердечно-сосудистой системы, системы
дыхания, ЦНС, печени и почек, так как, с одной стороны, именно эти системы
ответственны за поддержание жизнедеятельности, с другой — именно они в той или
иной степени являются «органами-мишенями» во время анестезии или вовлекаются в
процессы элиминации препаратов, используемых для ее (анестезии) поддержания
(подробнее в главах 2—5). Беременность накладывает существенные ограничения на
выбор метода анестезии. Здесь же необходимо сказать, что при возникновении
сомнений анестезиолог обязан привлекать для консультаций соответствующих
специалистов. Задача консультантов — помощь в интерпретации результатов тех
или иных специфических лабораторных тестов или исследований и назначении
соответствующего лечения. Анестезиолог не вправе ставить перед консультантом
вопрос о переносимости операции и степени подготовленности больного к ней. На
основании всего комплекса предоперационного обследования анестезиолог в
содружестве с хирургом решает вопрос о готовности больного к операции и несет
полную ответственность за принятое решение.
Проводимое лечение. Анестезиолог выясняет, какие
препараты получает больной для лечения основного и сопутствующих заболеваний.
Это необходимо для того, чтобы определить, как прием того или иного препарата
повлияет на течение анестезии, выявить возможный синергизм или антагонизм
лекарств и средств, которые предполагается использовать во время операции.
На основании точного знания
фармакокинетики и фармакодинамики препаратов анестезиолог принимает решение о
продлении курса лечения вплоть до дня операции или о целесообразности и
времени его прекращения.
Как правило, тщательно
подобранная терапия продолжается до начала операции. Исключение составляет
часть препаратов, используемых для лечения стенокардии, гипертонической болезни и сахарного диабета.
Некоторые общие подходы к предоперационной подготовке при наличии указанных
сопутствующих заболеваний будут изложены ниже.
Аллергологический анамнез и случаи проявления побочных,
извращенных реакций на лекарственные препараты собираются весьма тщательно.
При этом анестезиолог старается дифференцировать истинную аллергию на тот или
иной препарат от развития побочных эффектов, извращенных реакций или лекарственной
несовместимости. Больной, как правило, объединяет все эти явления под одним
названием «аллергия». Так, головные боли, связанные с приемом нитроглицерина,
являются побочным эффектом данного препарата, а вовсе не аллергической
реакцией и т.д. Выяснить это чрезвычайно важно, так как аллергическая реакция,
как правило, является противопоказанием к использованию обсуждаемого агента,
тогда как появление побочных эффектов далеко не всегда является препятствием к
назначению необходимого препарата.
Особое внимание следует
обращать на факты появления аллергических реакций на препараты, используемые
для анестезии. Необходимо прицельно спрашивать больного, получал ли он
когда-нибудь барбитураты, местные анестетики. Пищевая аллергия на рыбу может
указывать на возможность развития реакций на введение рентгеноконтрастных препаратов
и гепарина; на яйца и животный белок — заставляет осторожно относиться к
назначению белоксодержащих растворов и плазмы. Не стоит забывать, что если
пациент упоминает об аллергических реакциях на препараты сукцинилхолинового
ряда или фторотан (галотан), то это может указывать на возможность развития злокачественной
гипертермии.
Чаще всего побочные эффекты
от приема лекарственных препаратов проявляются в виде тошноты и рвоты. Следует
тщательно выяснить, прием каких именно препаратов
приводил к появлению нежелательных эффектов, и по возможности избегать их
использования. Особую настороженность следует проявлять к больным, страдающим
аллергическими или инфекционно-аллергическими заболеваниями: бронхиальной
астмой, экземой, псориазом и т.д. Если у анестезиолога имеются обоснованные
сомнения в переносимости тех или иных препаратов, применение которых
планируется или возможно во время анестезии, необходима постановка
соответствующих лабораторных проб.
Предшествующие анестезии. Следует обратить внимание
на переносимость и эффект от назначения седативных препаратов и наркотических
аналгетиков. Необходимо выяснить, были ли ранее проблемы с ларингоскопией и
интубацией трахеи, постановкой внутривенных канюль и инвазивным мониторингом.
Особое внимание следует обратить на пациентов, которые сообщают о
возникновении серьезных осложнений во время предыдущей анестезии: остановке
сердца, развитии инфаркта миокарда и/или нарушении мозгового кровообращения.
Следует помнить, что по ряду
причин больной не всегда может быть осведомлен о течении предыдущих анестезий,
поэтому указанием на серьезные проблемы во время ранее выполненной операции
может служить информация о неожиданно длительной ИВЛ или длительном сроке
пребывания в палате интенсивной терапии.
Необходимо, по возможности,
выяснить, какой вид анестезии был использован ранее и были
ли какие-либо нежелательные симптомы в раннем послеоперационном периоде:
рвота, тошнота и т.д. При положительном ответе на последний вопрос следует
тщательно продумать, как избежать указанных симптомов, может быть, даже
изменить метод анестезии.
Семейный анамнез и
социальный статус. Выясняют, страдают ли родственники пациента наследственными
заболеваниями или наследственной предрасположенностью к каким-либо
заболеваниям. Обязателен вопрос: «Отмечались ли у Ваших родственников серьезные
осложнения во время анестезии? Если да, то какие?» При
положительном ответе проводят соответствующее дополнительное обследование.
Курение вызывает серьезные опасения
в плане развития послеоперационных осложнений со стороны системы дыхания:
бронхитов, пневмоний, микро- и макроателектазов. Общим
правилом является полный запрет на курение за две недели до выполнения
операции, что значительно снижает риск развития вышеуказанных осложнений. Распространенное
мнение о том, что если человек много и долго курит, то риска не избежать, а
потому не стоит и запрещать курение, — не обоснованно и опасно.
Прием алкоголя. У лиц, злоупотребляющих
алкоголем, как правило, снижена чувствительность к седативным, наркотическим
препаратам и общим анестетикам. Необходимо тщательное исследование
сердечно-сосудистой системы, печени и почек, которые часто значительно
скомпрометированы. Возможно развитие надпочечниковой недостаточности. Кроме
того, у данной категории больных велик риск развития делирия, тремора и
гипертензии, что также необходимо учитывать во время и после анестезии. При
экстренной анестезии у лиц, находящихся в состоянии алкогольного опьянения,
необходимо помнить о возможном развитии гипотонии и гипогликемии. Потребность
в наркотических и седативных препаратах, общих анестетиках и миорелаксантах в
обсуждаемом случае снижена. Часто больные, страдающие алкоголизмом, сообщают о
том, что некоторое время назад им было имплантировано лекарство («Торпедо»,
«эспераль» и т.д.).
Нужно помнить о том, что
реальное действие подобных препаратов редко превышает шесть месяцев. В любом
случае это не накладывает серьезных ограничений на выбор метода анестезии.
Следует лишь избегать назначения алкоголя или лекарств, приготовленных на его
основе. В то же время необходимо помнить, что у данной категории больных велик
риск развития непредсказуемых реакций на тот или иной препарат, и избегать
полипрогмозии. Необходимо помнить, что алкоголизм, как и наркомания, — болезнь,
не имеющая «срока давности». Даже если больной говорит о том, что он уже в
течение ряда лет не употребляет спиртные напитки, все вышеизложенное не теряет
своей актуальности.
Наркомания. У данной категории больных,
как правило, снижена чувствительность к наркотическим и седативным препаратам.
Необходимо тщательное исследование сердечнососудистой системы, печени и почек,
которые часто значительно скомпрометированы. Возможно развитие надпочечниковой
недостаточности. По возможности следует избегать использования наркотических
аналгетиков (альтернатива — ингаляционный наркоз). Однако даже анестезия с
применением препаратов наркотического ряда очень редко приводит к рецидиву
болезни.
Осмотр
больного
Анестезиолог проводит осмотр
больного после лечащего врача, имея на руках результаты его осмотра и данные
амбулаторного обследования и/или выписку из истории болезни другого лечебного
учреждения, что существенно облегчает его задачу.
Необходимо знать рост и
массу больного, так как назначение большинства внутривенных препаратов производится
из расчета на 1кг массы или метр площади поверхности тела. Особое внимание
обращается на состояние сердечно-сосудистой системы, системы дыхания, включая
верхние дыхательные пути, и ЦНС.
При общем осмотре фиксируют
наличие цианоза, его локализацию и выраженность. Обращают внимание на наличие кожных
поражений, особенно в зоне предполагаемой установки катетеров. Оценивают
состояние микроциркуляции.
При исследовании ЦНС
обращают внимание на поведение больного, его вменяемость и дееспособность. Исследуют периферическую
чувствительность и движения конечностей (на предмет ранее перенесенных
инсультов).
Артериальное давление измеряют на обеих
конечностях. Наличие существенной разницы (более 20 мм Hg) может указывать на поражение
грудного отдела аорты или ее ветвей.
Исследование пульса дает сведения о наличии
(или отсутствии) аритмий. Редкий пульс может быть связан с приемом В-блокаторов,
частый — с лихорадкой, сепсисом или аортальной недостаточностью. Частый слабый
пульс скорее всего связан с гиповолемией.
Аускультация позволяет диагностировать или заподозрить пороки сердца,
экссудативньш перикардит.
Особое внимание следует
обратить на анатомию ротоглотки. Толстая короткая шея и избыточная масса вызывают
опасения в плане проведения ингубации трахеи. Исследуют широту открытия рта,
подвижность шеи (возможная амплитуда разгибания), движения языка.
Шрамы на шее — следы
перенесенных операций на щитовидной железе, трахее или трахеостомии — также
вызывают настороженность анестезиолога, который может провести диагностическую
ларингоскопию или фибробронхоскопию.
При выявлении значительного
смещения трахеи или иной патологии ротогпотки, влияющей на успех интубации,
можно предусмотреть интубацию трахеи с помощью фибробронхоскопа. Обращают
внимание на состояние зубов, наличие пародонтоза. Съемные челюсти или зубные
протезы извлекаются перед операцией.
Система дыхания и верхние
дыхательные пути. Оценивают частоту и глубину дыхания. Частое поверхностное дыхание
может свидетельствовать о болезнях ЦНС или выраженном ацидозе. Поверхностное
дыхание с парадоксальным движением грудной клетки или живота может говорить о
тяжелом наркотическом или алкогольном отравлении. Аускультация помогает
выявить бронхит, пневмонию, отек легкого, заподозрить респираторный
дистрес-синдром.
При осмотре живота обращают
внимание на подвижность передней брюшной стенки, наполнение желудка (опасность
регургигации), наличие перистальтики.
Лабораторные
и инструментальные методы исследования
При анализе результатов
различных лабораторных тестов врач-анестезиолог в первую очередь обращает
внимание на те параметры, которые способны повлиять на течение анестезии.
Существуют обязательный набор лабораторных тестов, которые выполняются любому
пациенту, поступившему в стационар, и дополнительные исследования, которые
проводят только при наличии соответствующих показаний.
Любому больному,
поступившему в стационар, в обязательном порядке проводятся:
— анализ крови на RW,
наличие антител к вирусу гепатитов и СПИДа, группу крови и резус-фактор. Наличие антител к
перечисленным возбудителям не является противопоказанием к проведению
анестезии в «холодный» период болезни, но заставляет персонал принять
дополнительные меры предосторожности: работа в «кольчужных» перчатках, с защитными
очками и т.д. После окончания операции необходима более тщательная дезинфекция
хирургического инструментария, наркозных аппаратов. Правила проведения дезинфекции
определяются соответствующими приказами МЗ РФ и возможностями клиники;
— общий анализ крови.
Обращают внимание на уровень НЬ и количество эритроцитов. Как правило, снижение
гемоглобина на 20—25% нормы легко переносится здоровыми людьми, но может
вызвать ишемию у лиц, страдающих ишемической болезнью сердца. В любом случае
необходимо выяснить этиологию анемии и, при необходимости, провести коррекцию.
Лейкоцитоз и ускоренное СОЭ могут свидетельствовать о воспалительном
процессе, лейкопения — о заболевании крови;
— общий анализ мочи.
Обращают внимание на удельный вес и наличие эритроцитов и лейкоцитов. При
отсутствии изменений, жалоб больного и соответствующего анамнеза дальнейшее
исследование функции мочевыделительной системы не проводят;
— рентгеноскопия органов
грудной клетки. только
при подозрении на патологический процесс в легких проводят дальнейшее
углубленное изучение.
Из других методов
исследования, при наличии соответствующих показаний, чаще всего используют
следующие:
— исследование газового и
электролитного состава плазмы. Проводится только при наличии указаний на
нарушение газового или водно-электролитного баланса. Анестезиолог
должен весьма критично оценить результаты проведенного исследования, так как
данный тест относится к методам экспресс-диагностики и полученные несколько
дней или даже часов назад результаты могут существенно отличаться от истинных
на момент обследования;
— исследование функции
внешнего дыхания. Проводят только у больных с патологией системы дыхания и
недостаточностью кровообращения. Снижение жизненной емкости легких и
дыхательных объемов может указывать на наличие рестриктивных заболеваний, тогда
как снижение скоростных показателей более характерно для пациентов с
обструктивными заболеваниями. В любом случае снижение
обсуждаемых показателей на 25% заставляет анестезиолога рекомендовать
проведение специфической физиотерапии, на 50% и более — тщательно разработать
стратегию и тактику интраоперационной респираторной терапии, отказаться от
методов анестезии, способных вызвать длительную депрессию дыхания, исследовать
возможность проведения анестезии с сохраненным спонтанным дыханием или в
возможно более ранние сроки перевести больного на самостоятельное дыхание и
т.д.
— ЭКГ. Электрокардиографическое
исследование выполняют всем больным старше 40 лет, учитывая, что ИБС может
протекать в безболевой форме или в виде так называемых эквивалентах
стенокардии, о чем больной может и не знать. В более молодом
возрасте — при наличии показаний. Помимо ИБС и ранее перенесенных инфарктов
миокарда, ЭКГ позволяет диагносцировать различные виды нарушения ритма сердца;
— коагулограмма.
Исследование выполняется всем больным, у которых предполагается операция на
сердце, магистральных сосудах, а также если есть
основания предполагать значительную интраоперационную кровопотерю. Заболевания
печени служат еще одним фактором для проведения
данного исследования;
— биохимический анализ
крови. Проводится больным с диабетом и предполагаемой скрытой или явной
почечной или печеночной недостаточностью.
Все остальные исследования
выполняются только при наличии строгих показаний.
ВЗАИМООТНОШЕНИЯ АНЕСТЕЗИОЛОГА И ХИРУРГА
Несмотря на то, что основную
ответственность за исход операции несет Оперирующий Хирург, Анестезиологу
принадлежит весьма важная роль в предупреждении и лечении различного рода
осложнений, возникающих во время оперативного вмешательства.
Как правило, при нормальных
отношениях внутри операционной бригады Оперирующий Хирург не вмешивается в
действия Анестезиолога и, более того, в наиболее ответственные моменты
операции выполняет некоторые его рекомендации. Например, Анестезиолог
определяет время прекращения искусственного кровообращения и деканюляции
сердца при операциях на сердце, выполняемых в условиях общего искусственного
кровообращения. Или для предупреждения резких изменений основных показателей
центральной гемодинамики по просьбе Анестезиолога Хирург производит
постепенное (а не одномоментное) снятие зажима с аорты при ее протезировании. В
этой связи Анестезиолог и Хирург совместно вырабатывают план дооперационного
обследования и лечения больного, решают вопрос о времени проведения операции.
Однако только Хирург имеет право свести воедино данные и мнения всех
специалистов и принять окончательное решение о проведении операции.
В случае возникновения
разногласий решающее слово принадлежит Хирургу. Анестезиолог обязан
информировать Хирурга о возможных последствиях принятого решения
и имеет право зафиксировать свое особое мнение в истории болезни.
При этом для отказа от
проведения анестезиологического пособия могут быть только две причины:
— нежелание пациента;
— техническая невозможность
выполнения операции.
Во всех остальных случаях
анестезиолог обязан сделать все от него зависящее и провести анестезию.
Анестезиолог выбирает метод анестезиологического обеспечения и несет ответственность за сделанный выбор.
ВЗАИМООТНОШЕНИЯ АНЕСТЕЗИОЛОГА И БОЛЬНОГО
Больной вправе знать все,
что касается его истинного состояния, риска предстоящего оперативного
вмешательства и возможных осложнений, включая вероятность летального исхода.
Данный подход носит название «информированное согласие» и означает, что:
— больной вправе знать о
своем состоянии все, что его интересует;
— без согласия больного
невозможно выполнение ни одного исследования, манипуляции или вмешательства.
Толыхо полная откровенность
анестезиолога в состоянии избавить больного от необоснованных волнений,
связанных с мыслью о том, что от него утаивают истинное положение вещей, только
такой подход может вьпвать его (пациента) полное доверие и желание
сотрудничать. Последнее — весьма важный фактор,
способный существенно повлиять на результаты лечения в целом. Вера больного в
анестезиолога, возникающая в процессе общения, — необходимый компонент
предоперационной подготовки, и поэтому проводить анестезию должен врач,
участвовавший в дооперационном обследовании. Замена анестезиолога возможна
только по очень веским причинам. Данная концепция в нашей стране представляется по меньшей мере спорной. Однако врачам,
придерживающимся иных точек зрения на лечение тяжелых, крайне тяжелых или
инкурабельных больных, следует помнить следующие обстоятельства:
— истинный диагноз и
реальный риск оперативного вмешательства при любом врачебном подходе чаще
всего являются для пациента секретом Полишинеля. Трудно сказать, что реально
причиняет пациенту большие страдания: знание истинного положения вещей, пусть
даже весьма печального, или терзания и сомнения, связанные с «последней
надеждой», или страх, связанный с мыслью, что его обманывают (особенно у больных,
диагноз которых не является приговором, а прогноз хирургического лечения представляется
вполне благоприятньм);
— отнюдь не факт, что врач
лучше больного может оценить все социальные, моральные, нравственные, семейные
и другие факторы, способные повлиять на решение выполнять или не выполнять
операцию;
— с последствиями того или
иного хирургического вмешательства, хорошими или плохими, предстоит
столкнуться пациентам и его родственникам: они (последствия) перестают быть
проблемой анестезиолога или хирурга через дни, недели, в худшем случае месяцы
после операции, а потому и право решать следует предоставить самому пациенту.
Тем не менее
следует признать, что данный подход не стоит возводить в абсолют, исключения
(редкие, а потому именно исключения) могут быть; кроме того, данный подход
связан с большей эмоциональной нагрузкой на врача и в силу этого обстоятельства
и традиций клиники не всегда легко и просто внедряется в жизнь.
Больной в предоперационном периоде должен знать:
— время, после которого ему запрещено есть и пить;
— время, когда необходимо
прекратить прием тех или иных лекарственных препаратов;
— предполагаемую
длительность операции;
— характер премедикации и
время ее проведения;
— последовательность событий
в день операции: время премедикации, транспортировки в операционную, порядок
постановки катетеров и метод вводного наркоза;
— предполагаемое время
(через сколыхо часов) и место пробуждения (палата интенсивной терапии, палата
пробуждения или общехирургическая палата).
Следует согласовать с
хирургом информацию, связанную с окончательным диагнозом, прогнозом результатов
оперативного лечения и хирургической тактикой.
С больным необходимо обсудить:
— тактику
анестезиологического обеспечения, включая необходимость интубации трахеи,
проведения искусственной вентиляции легких или технику регионарной анестезии.
Объяснить преимущество регионарной, если она предлагается, или общей анестезии
в данной конкретной ситуации;
— возможность изменения
анестезиологической тактики во время операции (например, переход с масочного
наркоза на ишубационный);
— риск анестезии и возможные
осложнения, с нею связанные. Больного необходимо предупредить о возможном
возникновении головных болей, местной инфекции и повреждении нервов при
регионарной анестезии; боли в горле, тошноте и рвоте после общей анестезии;
лихорадке, гепатите и реакции гемолиза после переливания крови; кровопотере и
пневмотораксе, связанных с постановкой катетеров в центральные вены.
Больной вправе высказать, а
анестезиолог по возможности выполнить пожелания о методе проведения анестезии.
Ни при каких обстоятельствах анестезиолог не вправе нарушить запрет больного на
проведение тех или иных мероприятий.
Например, члены религиозной
секты «Свидетели Иеговы» в силу религиозных убеждений отказываются от
переливания крови и ее компонентов. Врач не вправе сделать это ни при каких обстоятельствах,
но вправе отказаться проводить анестезию в подобных условиях. Решение
данного вопроса, по крайней мере по состоянию на
сегодня, не предусмотрено юридически и остается на совести медицинского
персонала. Конечно, отказ больного от проведения тех или иных лечебных мероприятий
должен быть надлежащим образом зафиксирован в истории болезни.
ЗАПИСЬ РЕЗУЛЬТАТОВ ПООПЕРАЦИОННОГО
ОСМОТРА
Данная запись должна
содержать:
— дату и время проведенного
осмотра, фамилию и должность врача;
— предполагаемый характер
вмешательства;
— кратко все данные
предоперационного обследования и лечения, влияющие на проведение
анестезиологического пособия. Обязательно отмечаются выявленные аллергические
реакции на тот или иной препарат. Фиксируются результаты предоперационного
лечения и его эффективность, отклонения от нормы, их этиология и связанные с
этим ограничения при проведении анестезии. При экстренной операции необходимо
указать, что те или иные необходимые диагностические или лечебные мероприятия
не проводились ввиду дефицита времени;
— резюме в виде оценки
физического состояния больного. Оценка проводится по шкале
Американской ассоциации анестезиологов (American Society of Anaesthesiologists — (ASA):
— класс 1 — пациенты, не
имеющие системных заболеваний;
— класс 2 — пациенты с
компенсированным системным заболеванием, не вносящим существенных ограничений
в физическую и социальную активность;
— класс 3 — пациенты с
серьезным системным заболеванием, которое ограничивает физическую и/или
социальную активность, однако может быть компенсировано в результате лечения;
— класс 4 — пациенты с
декомпенсированным заболеванием, требующим постоянного приема лекарственных
препаратов;
— класс 5 — пациенты, которые
могут погибнуть в течение 24 ч вне зависимости от того, будет или не будет
оказана им медицинская помощь.
Если операция проводится по
экстренным показаниям, к названию соответствующего класса добавляется буква «э»
(экстренная).
Запись анестезиолога
заканчивается заключением о предполагаемом варианте премедикации, вводного
наркоза и методике поддержания анестезии. Здесь же должны быть указаны мероприятия,
направленные на предупреждение осложнений, развития которых следует опасаться
вследствие выявленных особенностей физического статуса больного.
Больной письменно
подтверждает свое согласие на предложенный вариант анестезиологического
обеспечения. На рис. 1.1 приводится стандартная форма, заполняемая
анестезиологом и подписываемая больным накануне операции в Институте хирургии
им. А.В. Вишневского РАМН.
Следует иметь в виду, что
хотя и имеется связь между риском анестезии и оценкой физического состояния
больного, но это далеко не одно и то же.
Риск анестезии призван
оценить шансы конкретного пациента перенести конкретную операцию в конкретных
условиях. Подобный подход имеет два серьезных ограничения:
— существующие классификации
(А.А. Бунятян, 1984) в попытке учесть все возможные факторы, влияющие или способные
повлиять на результаты операции, становятся весьма громоздкими и неудобными в
практическом применении. Грани между классами, в силу вышеизложенных причин,
расплывчаты, и разные анестезиологи могут отнести одного и того же больного к различным
классам (подклассам) и т.д. Кроме того, ни одна классификация не в состоянии
учесть такие важные факторы, как квалификация хирурга, анестезиолога, наличие и
качество имеющихся наркозно-дыхательных аппаратов, реальный объем мониторинга
и т.д.;
— стремление детализировать
физический статус и риск анестезии ничего не прибавляет к стройной системе
оценки, предложенной Американской ассоциацией анестезиологов. Если мы решили,
что оперативное вмешательство необходимо и неизбежно, то его результаты будут
зависеть, при прочих равных условиях, именно от физического статуса больного.
И все же следует иметь в
виду, что классификация ASA позволяет оценить шансы
больных перенести одну и ту же конкретную операцию, но не позволяет сравнить
переносимость разных операций для одного и того же больного. Например, больной,
отнесенный к ASA2, имеет больше шансов перенести аортокоронарное
шунтирование без жизнеопасных осложнений, чем больной, отнесенный к ASA4.
Однако нельзя сказать, что больной группы ASA2 легче перенесет указанную
операцию, чем больной группы ASA4 — холецистэктомию.

Рис. 1.1. Форма записи
результатов пооперационного осмотра
В связи с
вышеизложенным представляется, что оценка физического
состояния больного по шкале ASA дает больше конкретной информации
анестезиологу и точнее нацеливает его на предупреждение возможных осложнений
при выполнении оперативного вмешательства.
Глава 2
ОСОБЕННОСТИ
ПРЕДОПЕРАЦИОННОГО ОБСЛЕДОВАНИЯ И АНЕСТЕЗИОЛОГИЧЕСКОГО ОБЕСПЕЧЕНИЯ ПАЦИЕНТОВ С
ЗАБОЛЕВАНИЯМИ СИСТЕМЫ ДЫХАНИЯ
А.В. Ситников
Осложнения со стороны легких являются второй по значимости (после осложнений со стороны сердца) причиной летальности в интра- и ближайшем послеоперационном периоде. Это связано с тем, что анестезия и операция вызывают особенно выраженную гиповентиляцию, гипоксемию и гиперпродукцию бронхиального секрета у пациентов со скомпрометированной системой дыхания. Пациенты указанной группы наиболее тяжело переносят операции на органах грудной полости и верхнем этаже брюшной полости. Вместе с тем целенаправленная медикаментозная и физиотерапия в предоперационном периоде могут существенно снизить риск анестезии у лиц с заболеваниями системы дыхания.
Если у больного
диагностирована гипоксия, для анестезиолога принципиально важно выявить
характер расстройства. Основная задача врача-интенсивиста в принципе состоит в
обеспечении оптимального уровня транспорта кислорода. Содержание кислорода в
артериальной крови описывается формулой
СаО2= [(l,37)х(Hb)х(SaО2)]
+ [(0.003)х(РаО2)],
где 1,37 — количество кислорода, связанного с полностью оксигенированной молекулой гемоглобина, мл;
НЬ — концентрация
гемоглобина (г/дл);
SaO2 — насыщение артериальной
крови кислородом;
0,003 — константа
растворимости кислорода в плазме;
РаО2
— парциальное давление кислорода в плазме крови. Из данной формулы
очевидно, что для поддержания эффективной оксигенации можно:
— увеличить количество
гемоглобина (переливание отмытых эритроцитов, донорской крови и т.д.). Об
этом не следует забывать, так как при комбинации умеренной анемии с острой
(или хронической) сердечной недостаточностью может развиться выраженная
гипоксия. И одним из наиболее простых путей ее устранения может стать
коррекция анемии;
— повысить насыщение
кислородом артериальной крови. Здесь возможны различные варианты:
— увеличение FiO2 (удельного содержания
кислорода во вдыхаемой смеси). Данный путь имеет свои ограничения, так как
дыхание 100% кислородом уже через 2 ч может привести к необратимым изменениям
альвеоло-артериальной мембраны. Грозным предвестником данного состояния
является увеличение альвеоло-артериальной разницы по кислороду, которая в норме
не должна превышать 3—6%. В этой связи ряд современных наркозно-дыхательных
аппаратов оснащен опцией, не позволяющей увеличить FiO2 более чем до 80%. К
сожалению, отечественная техника не позволяет мониторировать обсуждаемый
показатель. Баллоны со сжатым кислородом, как правило, содержат
кислородно-воздушную смесь с содержанием О2 порядка 94—97%. В то же
время следует учитывать, что ввиду негерметичности контура аппарат РО-6Н,
проработавший год, не в состоянии обеспечить доставку газово-наркотической
смеси с FiO2 более 80—85%, даже если по ротаметрам вентиляция
осуществляется «чистым» кислородом;
— создание «плато» в фазу
вдоха;
— изменение соотношения
вдох/выдох, вплоть до инверсного;
— изменение формы кривой
потока в фазу вдоха и т.д. Гипоксия, в свою очередь, может быть:
— респираторной.
Классический пример — обструкция бронха инородным телом. Кроме того, в
результате ателектаза, гидро-, гемо-, пневмоторакса и т.д.;
— циркуляторной. В
результате острой сердечной недостаточности, анемии снижается транспорт
кислорода тканям, и гипоксия возникает вследствие дефицита кислорода в условиях
неизменного его потребления. Учитывая, что коэффициент экстракции кислорода
тканями никогда не может быть равен 1, необходимо создавать условия, при
которых транспорт кислорода превышал бы его потребление как минимум на 50%;
— тканевой,
при которой транспорт кислорода достаточен, но страдает его потребление
тканями. Наиболее яркий пример — нарушение сопряжения процессов окисления и
фосфорилирования при отравлении цианидами (например, при длительном, бесконтрольном
применении нигропруссида Na).
Гипоксия возникает в
ситуации, когда транспорт кислорода недостаточен для удовлетворения
метаболических потребностей организма.
Алгоритм действия
анестезиолога для установления причин возникновения гипоксии
и ее коррекции
Проверяются
— Поступление кислорода в контур пациента:
— нарушение в системе подачи
кислорода;
— к кислородной линии
подключен какой-либо иной газ;
— ротаметр кислорода
неисправен или неправильно откалиброван;
— утечка в контуре;
— не работает аппарат ИВЛ;
— обструкция в контуре;
— неправильная интубация
(интубация пищевода).
— Гиповентиляция.
— Нарушение веншляционно-перфузионных соотношений —
ателектаз, пневмония, отек легких, респираторный дистресс-синдром, пневмоторакс
и т.д. Ошибочная эндобронхиальная интубация.
— Снижение кислородтранспортной функции крови — шок,
анемия, метгемоглобинемия и наличие патологичеких гемоглобинов.
— Смещение кривой диссоциации оксигемоглобина влево
вследствие гипотермии, алколоза, гипокапнии, снижения уровня 2;
3-дифосфоглицерата в эритроцитах.
— Право-левый шунт.
— Шок любой этиологии вызывает неадекватную перфузию
тканей.
Терапия
— Переход на ручную вентиляцию чистым кислородом,
поиск утечки в контуре, верификация положения интубационной трубки,
аускультация легких и т.д.
— Санация трахеобронхиального дерева.
— Проверка FiO2 кислородным анализатором.
— Терапия шока, если наблюдается нарушение перфузии тканей.
КЛАССИФИКАЦИЯ
ЗАБОЛЕВАНИЙ ЛЕГКИХ
Для
анестезиолога принципиально важно разделение заболеваний легких на
обструктивные, связанные с нарушением пассажа воздуха через трахеобронхиальное
дерево, и рестриктивные, т.е. связанные с поражением легочной паренхимы.
Рестриктивные
заболевания
Рестриктивные заболевания
легких связаны с нарушением податливости (растяжимости) легочной ткани и могут
быть хроническими и транзиторными (проходящими). Сопротивление дыхательных
путей обычно нормальное, тогда как легочные объемы в той или иной степени
снижены. При изучении легочной механики обращает внимание снижение легочного комплайенса.
Транзиторные
заболевания
Заболевания, связанные с
поражением легочной паренхимы: пневмонии, в том числе аспирационная пневмония,
— чаще
всего результат рвоты или регургитации во время вводного наркоза (синдром
Мендельсона). Общая анестезия вызывает угнетение всех условных и безусловных
рефлексов, в том числе рефлексов со слизистой трахеи и бронхов, и таким образом
создает условия для попадания в них желудочного содержимого. Данный процесс
может происходить на фоне самостоятельного дыхания в результате аспирации
рвотных масс (аспирация) или же в результате пассивного затекания желудочного
содержимого в трахею у пациента, оперируемого в условиях тотальной миоплегии
(регургитация).
И в том и в другом случае
могут возникнуть бронхоспазм, ателектазирование, гипоксемия. Выраженность
симптомов зависит от объема аспирационных масс и их рН. При попадании в трахею
более 0,4 мл/кг аспирационных масс с рН менее 2,5 развивается состояние,
описанное в литературе как синдром Мендельсона. Последний характеризуется
химическим ожогом слизистой трахеи и бронхов с развитием трахеобронхита, микро- и макроателектазированием с развитием пневмонии и/или
респираторного дистресс-синдрома. Смертность при синдроме Мендельсона очень
высока и зависит от своевременности лечебных мероприятий.
Предрасполагающими факторами
к аспирации/регургитации являются:
— замедленная эвакуация из
желудка или двенадцатиперстной кишки;
— беременность;
— ожирение;
— регургитация в анамнезе.
Для профилактики аспирации и регургитации необходимо:
— тщательно готовить
пациента к плановой операции (легкий ужин накануне, запрет на прием воды и
пищи в день операции; пациент может быть взят на плановую операцию не ранее
чем через 6 ч после приема пищи; если есть основания предполагать
замедленную эвакуацию из желудка, необходимо опорожнение желудка через толстый
зонд);
— промывание желудка перед
экстренной операцией;
— проводить вводный наркоз и
ишубацию пациента в положении с опущенным головным концом, если есть основание
предполагать наличие содержимого в желудке;
— использовать прием Селика
(давление рукой на перстневидный хрящ в момент интубации);
— следить за тем, чтобы
манжетка интубационной трубки полностью перекрывала просвет трахеи;
— использовать желудочный зонд при любых операциях на органах брюшной полости, проводимых в условиях общей анестезии и ИВЛ;
— использовать желудочный зонд при любых операциях продолжительностью более 3 ч, проводимых в условиях общей анестезии и миоплегии.
При возникновении аспирации/регургигации следует:
— перевести больного в
положение Тределенбурга и повернуть ему голову в сторону;
— тщательно санировать
ротоглотку с помощью салфеток и отсоса, после чего обязательно интубировать;
— провести бронхоскопию,
лаваж легких;
— при невозможности
проведения санационной бронхоскопии — лаваж до «чистой воды»;
— массивная терапия
стероидами;
— антибиотикотерапия — по
показаниям, строго обязательна при синдроме Мендельсона или предположении о
возможном его развитии;
— терапия возникших осложнений:
респираторная терапия при гипоксии, медикаментозная при бронхоспазме и т.д.
Туберкулез, саркаидоз и другие заболевания,
связанные с поражением легочной паренхимы, также входят в группу рестриктивных
заболеваний легких. При прогрессировании данных заболеваний развивается
«легочное сердце» и легочная гипертензия. Вплоть до финальной стадии газовый
состав крови может оставаться нормальным.
Респираторный
дистресс-синдром взрослых (РДС). Патофизиология заболевания связана с нарушением
проницаемости альвеолярной мембраны и увеличением содержания жидкости с высоким
содержанием белка в просвете альвеол и интерстиции. Альвеолокапиллярная
диффузия газов резко нарушается. РДС — финальная стадия многих системных
заболеваний и расстройств, например шока различной этиологии, массивной
кровопотери, сепсиса и т.д. Газовый состав крови резко изменен с самого начала
заболевания. Требует интенсивной медикаментозной и респираторной терапии,
вплоть до проведения ИВЛ.
Четыре основных компонента
считаются обязательными при проведении ИВЛ при РДС:
— прессциклическая
вентиляция (менее опасна в плане баротравмы легких, которая весьма вероятна при
данном страдании). При отсутствии подобной опции у вентилятора используют
обычную объемную вентиляцию, но тщательно следят за максимальным давлением на
вдохе (не должно превышать 30 см вод. ст.) и легочньм комплайенсом (см. главу «Мониторинг»).
— нисходящая
форма кривой потока в фазу вдоха, что позволяет добиться инспираторного
открытия спавшихся альвеол;
— инверсное соотношение вдох/выдох,
вплоть до 4:1, — продлевает время активного транскапиллярного обмена газов;
— создание «переходящего» PEEP (positive end expired pressure —
положительное давление в конце выдоха) позволяет поддерживать легкие как бы
«подраздутыми», что, в свою очередь, помогает бороться с гиповентиляцией и
препятствует образованию микро- и макроателектазов,
последнее весьма характерно для развития РДС. В данном случае, по мнению большинства
исследователей, PEEP, создаваемый при объемной вентиляции, менее эффективен,
хотя данный факт, насколыхо известно, никем не был доказан.
Следует помнить, тем не
менее, что в патогенезе РДС существенную роль играют
вентиляционно-перфузионные расстройства, возникающие вследствие вентиляции
неперфузируемых отделов легких, и наоборот.
При спонтанном дыхании
происходит чередование отделов легких, участвующих в газообмене, что позволяет
поддерживать ткань легких в активном физиологическом состоянии.
До настоящего времени, к
сожалению, не разработано режима ИВЛ (или вспомогательной вентиляции),
способного сохранить подобный механизм.
Использование режима CMV+sigh
(т.е. подача двойного объема через каждые 50—100 циклов) не решает обсуждаемой
проблемы, так же как и использование режимов PEEP или СРАР (continues positive airway pressure
— положительное давление в дыхательных путях).
Медикаментозная терапия и
профилактика РДС включает обязательное использование стероидов, антибиотиков,
диуретиков и т.д. В последние годы не без успеха используются естественные и
синтетические сурфактанты.
В принципе, развернутый
РДС-синдром — грозное осложнение ряда заболеваний, требующее немедленной интенсивной терапии. Но даже при этих условиях
смертность достигает 60— 70%.
Отек легких —
интерстициальный или альвеолярный отек, возникающий чаще всего вследствие
левожелудочковой недостаточности.
Лечение в первую очередь
должно быть направлено на борьбу с острой сердечной недостаточностью, хотя
состояние может потребовать перевода на ИВЛ и проведения респираторной терапии (см. главу
«Интраоперационное управление гемодинамикой»).
Пневмоторакс
Состояние, развивающееся в
результате попадания воздуха в плевральную полость. Оно возникает при:
— спонтанном разрыве шварты или буллы в легком;
— проникающем ранении грудной клетки;
— хирургической операции в соответствующей
области;
— как осложнение ряда
манипуляций (катетеризации подключичной или внутренней яремной вены, торако-, перикардиоцентезе и т.д.);
— как осложнение вентиляции
с высоким давлением на вдохе. Возникающая баротравма и повреждение стенок альвеол
могут привести к развитию пневмоторакса.
Клинические проявления
пневмоторакса зависят от объема воздуха, попавшего в плевральную полость.
При малых объемах
пневмоторакс может никак себя не проявлять. При больших объемах легкое
коллабируется, возникает гипоксия.
Особенно опасен напряженный
(клапанный) пневмоторакс — ситуация, когда происходит постоянное нагнетание
воздуха в плевральную полость без его эвакуации. При этом происходит смещение
средостения со сдавлением сердца и магистральных сосудов.
Диагноз ставится на основании аускультации (ослабленное дыхание), уменьшения легочного
комплайенса, увеличения пикового давления на вдохе, гипоксии. Верификация —
при рентгенографии легких.
Лечение
Заключается в немедленной
эвакуации пневмоторакса. Пункция производится во 2—3 межреберье по
среднеключичной линии.
Независимо от причин у лиц,
находящихся на ИВЛ или которым предполагается выполнение операции в условиях
общей анестезии, устанавливается пассивный дренаж.
Хронические заболевания:
— плевриты («сухие» и
экссудативные). Следует помнить, что подавляющее большинство плевритов имеет
туберкулезную этиологию;
— различные врожденные или
прибретенные деформации грудной стенки;
— высокое стояние диафрагмы,
которое может быть следствием ожирения, асцита, беременности и т.д.
При рестриктивных
заболеваниях гипоксия первична, а нарушения вентиляционно-перфузионных
соотношений возникают позднее.
Обструктивные
заболевания
К обструктивньм заболеваниям
относятся те, которые вызывают увеличение сопротивления в дыхательных путях:
— прежде всего, по тяжести
состояния и возможным неблагоприятным последствиям следует говорить о
бронхиальной астме — заболевании, связанном с затрудненным выдохом вследствие
экспираторной обструкции бронхов разного калибра. Последнее в свою очередь,
связано с комплексом причин, включая гиперпродукцию бронхиального секрета, с
повышенной сократимостью мышечного слоя верхних дыхательных путей и их
отеком. Наиболее частой этиологической причиной страдания являются инфекционные
заболевания легких и аллергия на различные медикаментозные и немедикаментозные
вещества. Обязательна постановка аллергических проб на все препараты, которые
предполагается использовать во время анестезии. Учитывая, что из всех
анестезиологических препаратов наиболее выраженным бронходилатирующим действием
обладает фторотан, имеет смысл продумать возможность его использования для
вводного наркоза и/или для поддержания анестезии. По возможности следует
избегать использования пропанидида (эпонтол, сомбревин — выраженный аллергоген,
запрещенный к использованию в ряде зарубежных стран), гексенала и тиопентала Na
(наличие сульфогидрильных групп может спровоцировать развитие аллергии), в
меньшей степени наркотических аналгетиков;
— хронический бронхит
приводит к гиперпродукции бронхиального секрета и сужению просвета бронхов и
бронхиол или даже их обструкции. Наиболее распространенная причина хронического
бронхита — курение. У пациентов данной группы относительно рано выявляются
гипоксия и гиперкапния. «Легочное сердце» развивается на поздних стадиях
заболевания как закономерный
финал легочной гипертензии и правожелудочковой недостаточности;
— эмфизема легких — финал
ряда заболеваний легких, выражающаяся в уменьшении эластичности альвеол и иных
легочных структур. Это, в свою очередь, приводит к преждевременному закрытию
(коллапсу) воздухоносных путей при большем, чем в норме, остаточном легочном
объеме. Компенсация достигается за счет увеличения минутной вентиляции (МОД).
Гипоксия и гиперкапния появляются на поздних стадиях заболевания;
— констриктивный фиброз —
заболевание, связанное с гиперпродукцией бронхиального секрета повышенной вязкости,
содержащего большое количество сахаров. Это приводит к обструкции дыхательных
путей и их фиброзу. Больные данной группы предрасположены к развитию
инфекционных заболеваний легких. Позднее появляются брохоэктазы и признаки
дыхательной недостаточности.
Основной причиной гипоксии
при обструктивных заболеваниях легких является нарушение
вентиляционно-перфузионных соотношений.
Нарушение дыхания возникает
вторично, вследствие увеличенной работы дыхания по преодолению повышенного
сопротивления в дыхательных путях.
Нередко больные имеют
признаки как обструктивного, так и рестриктивного заболевания.
Задача анестезиолога на пооперационном
этапе — выявить этиологию страдания, понять его ведущий компонент и назначить
соответствующую терапию с целью добиться максимально возможного уровня
компенсации.
ОБЩИЙ ОСМОТР И СБОР АНАМНЕЗА
При сборе анамнеза выясняют
наличие у больного хронических легочных заболеваний (пневмония, туберкулез и
т.д.), а также социальные и профессиональные факторы, способствующие их
появлению: профессиональная вредность (работа в загазованном, запыленном
помещении, работа с асбестом, цементом и т.д.), курение.
Обращают внимание на кашель
(возможно, бронхит — необходимо углубленное исследование), нарушение дыхания.
Физикальный
осмотр
При осмотре больного
фиксируют внимание на:
— цианозе, который может быть
проявлением целого ряда расстройств: снижения уровня транспорта кислорода,
ухудшения микроциркуляции и перфузии тканей, резкого увеличения потребления
кислорода тканями, снижения уровня НЬ;
— ожирении, беременности и
искривлении позвоночника (указанные состояния приводят к снижению жизненной
емкости и податливости легких и вызывают предрасположенность к
ателектазированию и гипоксии);
— кахексии, которая в силу
ряда причин (слабость мускулатуры, в том числе и дыхательной, гипопротеинемия,
нарушения иммунного статуса) вызывает предрасположенность к пневмонии.
При осмотре грудной клетки отмечают выраженные
экспираторные усилия, что может указывать на наличие обструктивного заболевания
легких; участие вспомогательных мышц (межреберных,
грудино-ключично-сосцевидной и т.д.); асимметричное движение грудной клетки при
дыхании, что наблюдается при плеврите, пневмо-, гидро- и гемотораксе,
поражении левой или правой ветви диафрагмального нерва.
При аускультации фиксируют тип дыхания
(везикулярное, жесткое и т.д.), наличие патологических шумов и хрипов. При
аускультации сердца следует иметь в виду, что акцент второго тона над легочной
артерией может свидетельствовать о наличии легочной гипертензии, развившейся
вследствие хронического обструктивного заболевания легких.
Лабораторные
и инструментальные исследования
Рентгенологическое
исследование легких (рентгенография, томография и компьютерная томография)
остается наиболее информативным методом диагностики заболеваний системы
дыхания. Из прочих следует назвать:
— исследование газового
состава артериальной крови. Снижение РаО2 ниже 60 мм Hg при
вдыхании атмосферного воздуха свидетельствует о наличии гипоксии и повышенном
риске развития интра- и послеоперационных осложнений со стороны системы
дыхания. Увеличение РаСО2 выше 45 мм Hg в покое свидетельствует о
финальной стадии легочного заболевания и об отсутствии у пациентов какого бы
то ни было резерва системы дыхания. Риск развития легочных осложнений крайне
высок. Имеет смысл исследовать газовый состав именно артериальной крови, в
ряде случаев — смешанной венозной крови (см. главу «Мониторинг»).
Исследовать газовый состав капиллярной крови («из пальца») не имеет смысла, так
как слишком много факторов может привести к одним и тем же изменениям.
Помимо истинной гипоксии это
могут быть:
— нарушения микроциркуляции
вследствие шока, гиповолемии и т.д.;
— нарушения регионарной
гемодинамики вследствие вынужденного положения руки, сосудистой патологии и
т.п.;
— уровень рН, который изменяется
параллельно с РаСО2, может свидетельствовать о респираторном ацидозе
или алкалозе;
— функциональное
исследование легких с определением объемных и скоростных показателей — ценный дополнительный
метод диагностики обструктивных и рестриктивных заболеваний, что более важно,
данный тест позволяет оценить эффект предоперационной терапии и резервные
возможности системы дыхания;
— электрокардиография, которая позволяет
диагностировать легочную гипертензию. ЭКГ-признаками легочной гипертензии
являются: смещение электрической оси сердца вправо, легочный зубец Р
(высота Р более 2,5 мм), гипертрофия правых отделов сердца, блокада
правой ножки пучка Гиса.
ПРЕДОПЕРАЦИОННОЕ ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ
СИСТЕМЫ ДЫХАНИЯ
Цель предоперационного
лечения — добиться максимально возможного эффекта в лечении заболеваний легких
и таким образом уменьшить риск развития интра- и послеоперационных осложнений
со стороны системы дыхания.
За две недели (в крайнем
случае за 24—48 ч) до операции больному запрещают курить. Это позволяет
уменьшить содержание карбоксигемоглобина в крови больных и вызывает смещение кривой диссоциации
оксигемоглобина вправо. Отказ от курения за 2—4 недели до операции позволяет
надеяться на восстановление нормальной функции эндотелия бронхов.
Необходимо провести
адекватную терапию выявленного инфекционного заболевания легких. Операция по
возможности откладывается до полного выздоровления пациента. При наличии
гидро- и гемоторакса производят пункцию с аспирацией содержимого до вводного
наркоза. При наличии пневмоторакса производят дренирование плевральной полости.
Пассивный дренаж (например, по Бюлау) оставляют на все время проведения ИВЛ, в
противном случае высока вероятность развития напряженного пневмоторакса.
Предоперационная
физиотерапия, как правило, позволяет в той или иной степени улучшить состояние
больных хроническими легочными заболеваниями и, следовательно, уменьшить риск
развития послеоперационных осложнений со стороны системы дыхания.
При гигантских грыжах делают
пробу со стягиванием, что позволяет в дооперационном периоде прогнозировать
вероятность развития острой дыхательной недостаточности после операции.
Если в результате пробы
выявлено значительное снижение объемных показателей, дается рекомендация
хирургам проводить пластику передней брюшной стенки методами, не приводящими
к уменьшению объема брюшной полости (использование синтетических материалов
(«сетка»), твердой мозговой оболочки и т.д.).
ОСОБЕННОСТИ ПРЕДОПЕРАЦИОННОЙ ПОДГОТОВКИ
БОЛЬНЫХ ХРОНИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ ЛЕГКИХ (ХЗЛ)
Как правило, больные ХЗЛ
получают плановую медикаментозную терапию:
— симпатомиметики или В-агонисты
вызывают бронходилатацию вследствие влияния на аденилатциклазу (увеличение
содержания цАМФ приводит к расслаблению гладкой мускулатуры бронхов; препараты
с неспецифической активностью в отношении В1 и В2-рецепторов:
адреналин, изопротеренол и т.д. могут провоцировать развитие аритмий и
тахикардии; они с осторожностью должны использоваться у больных с ИБС; время
отмены препаратов перед операцией решается индивидуально; прием селективных В2-агонистов
(алупент), как правило, продолжают до операции);
— ингибиторы фосфодиэстеразы
(эуфиллин) увеличивают содержание цАМФ и обладают бронходилатирующим эффектом
(данные препараты показаны больным с ХОЗЛ, бронхиальной астмой; лечение
тщательно подобранной дозой препарата продолжается до дня операции; обычная
доза — 300—1500 мг/сут.; эуфиллин стандартно назначается курильщикам за 7 дней
до операции);
— кортикостероиды назначаются
больным ХОЗЛ, нечувствительным к действию В-агонистов и ингибиторов
фосфодиэстеразы; при их назначении рассчитывают на угнетение отечности
эпителия бронхов и снижение их секреции, стабилизацию плазматической мембраны
клеток и уменьшение секреции гистамина; тщательно подобранная терапия
продолжается до операции;
— парасимпатолитики (атропин)
обладают прямым бронходилатирующим эффектом вследствие угнетающего влияния на
гуанилатциклазу (уменьшение содержания цГМФ); назначаются в виде ингаляций,
терапия продолжается до момента операции;
— муколитики снижают и делают
менее вязким секрет бронхов; назначаются в виде ингаляций, терапия продолжается
до дня операции.
Премедикация
Больные, постоянно получающие
В-агонисты или кортикостероиды, имеют при себе ингалятор до начала
вводного наркоза.
Следует особенно осторожно
относиться к назначению бензодиазепинов и наркотических аналгетиков из-за опасности
угнетения дыхания с развитием гипоксии.
ВЛИЯНИЕ АНЕСТЕЗИИ И ОПЕРАЦИИ НА ФУНКЦИЮ
ЛЕГКИХ
Общая анестезия приводит к
уменьшению легочных объемов и изменению вентиляционно-перфузионных
соотношений. Как правило, общие анестетики снимают регулирующий эффект гипоксии
и гиперкапнии на дыхательный центр. У больных со скомпрометированной системой
дыхания высока вероятность развития ателектазов в послеоперационном периоде.
Послеоперационная боль еще
более усугубляет расстройства легочной функции, так как ограничивает
подвижность грудной клетки и мешает больному откашляться.
Механическая вентиляция (ИВЛ)
при сравнении со спонтанным дыханием вызывает изменение
вентиляционно-перфузионных соотношений.
Вследствие создания
положительного давления на вдохе нескомпрометированные участки легких получают
большую порцию газовой или газонаркотической смеси. Кровоток в системе
легочной артерии определяется силой тяжести и увеличен в пораженных отделах
легких.
Таким образом, ИВЛ вызывает
как увеличение физиологического мертвого пространства, так и внутрилегочное
шунтирование крови (Qs/Qt,).
Операция приводит к
выраженному изменению (уменьшению) объемных параметров дыхания. Так, операция
на верхних отделах брюшной полости приводит к уменьшению ЖЕЛ на 75%, а на
органах грудной полости — на 50%. Причем восстановление нормального объема
дыхания занимает в лучшем случае неделю.
Операции на конечностях не
сопровождаются столь существенными изменениями механики дыхания.
Кроме того, следует
учитывать, что в физиологических условиях вдыхаемый воздух подогревается и
увлажняется в верхних дыхательных путях. Медицинские газы, особенно кислород,
обладают выраженным дегидратирующим влиянием и вызывают резкую «сухость»
бронхиального дерева. Данный эффект еще более усугубляется при эндотрахеальном
наркозе. Все это приводит к повреждению эпителия бронхов и способствует
развитию послеоперационнык бронхитов и пневмоний.
В этой связи принципиально
важно пользоваться увлажненной и подогретой газонаркотической смесью, особенно
при длительных операциях (в настоящее время имеется возможность использовать
сухие увлажнители и теплосберегатели, совмещенные с абактериальным фильтром).
Использование увлажнителей снижает частоту развития послеоперационных
бронхитов на 27%, а у лиц с хроническим бронхитом позволяет избежать развития
пневмоний у 47% случаев.
ОСОБЕННОСТИ АНЕСТЕЗИОЛОГИЧЕСКОГО ПОСОБИЯ
Показана кислородотерапия сразу
после поступления в операционную.
Регионарная анестезия
является предпочтительной для данной категории больных. Это особенно относится
к операциям на конечностях и нижнем этаже брюшной полости.
Общая анестезия показана в
торакальной хирургии и при операциях на верхнем этаже брюшной полости. По
возможности используют сочетание эпидуральной и общей анестезии в надежде
сократить расход наркотических аналгетиков, уменьшить выраженность
послеоперационной депрессии дыхания и как можно раньше перевести пациента на
самостоятельное дыхание.
Обязательно использование
увлажнителей во время операции. В послеоперационном периоде — тщательно
подобранная респираторная терапия, ранняя активизация больных и ранняя
физиотерапия могут уменьшить количество осложнений со стороны системы дыхания.
Глава 3
ОСОБЕННОСТИ
ПРЕДОПЕРАЦИОННОГО ОБСЛЕДОВАНИЯ И АНЕСТЕЗИОЛОГИЧЕСКОГО ОБЕСПЕЧЕНИЯ ПАЦИЕНТОВ С ЗАБОЛЕВАНИЯМИ
СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
В.В.
Субботин
Осложнения со стороны сердечно-сосудистой системы являются ведущей причиной летальности и возникновения жизнеопасных осложнений во время и после оперативных вмешательств. Учитывая, что по разным показаниям в мире ежегодно оперируются около 1 млн. человек с сопутствующей патологией сердца, несложно представить всю важность обсуждаемой проблемы. В этой связи анестезиологу необходимо знать и понимать, как предупреждать и лечить возможные осложнения.
Среди прочих страданий
ишемическая болезнь сердца (ИБС) и инфаркт миокарда (ИМ), как ее закономерный
финал, в наибольшей степени опасны в плане прогноза предстоящей операции и
анестезии.
ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
В этиологии ишемической
болезни сердца на первом месте стоит атеросклероз, хотя гипертрофия миокарда
при кардиомиопатии и аортальном пороке также могут приводить к ишемическим
атакам. ИБС — это всегда несоответствие между транспортом кислорода к миокарду
(ТмО2) и его потреблением (MVO2). Следует помнить, что
кровоснабжение миокарда осуществляется за счет двух венечных артерий (правой и
левой) и их ветвей, отходящих от аорты позади створок аортального клапана
сердца. Коронарная перфузия осуществляется в основном за счет антеградного
давления крови в фазу диастолы, которое определяется как разность между
диастолическим артериальным давлением (АДдиа) и центральным венозным давлением
(ЦВД).
Исследования
последних лет показали, что коронарная перфузия осуществляется также и в фазу
систолы, причем вклад данного механизма в кровоснабжение миокарда кислородом
значительно больше, чем было принято думать. Данный феномен частично
объясняет, как осуществляется коронарная перфузия у лиц с аортальной
недостаточностью IV степени. Тем не менее считается, что коронарный кровоток
прямо пропорционален перфузионному давлению и обратно пропорционален коронарному
сосудистому сопротивлению. В норме коронарный кровоток у среднестатистического
человека (масса тела 70 кг) составляет величину порядка 250 мл/мин и может увеличиваться
в 4—5 раз, чтобы компенсировать возросшие потребности миокарда в кислороде,
например во время физической нагрузки.
Увеличение частоты сердечных
сокращений (ЧСС) приводит к укорочению периода диастолического заполнения и
уменьшению коронарного кровотока. Поэтому больные ИБС, как правило, плохо
переносят тахикардию. На этом, кстати, основано определение резервных
(компенсаторных) возможностей миокарда при проведении пробы с чреспищеводной
кардиостимуляцией.
О работе сердца можно судить
по двум ключевым параметрам:
— сердечному индексу (СИ),
который определяется как частное от деления минутного объема сердца (МОС) на
площадь поверхности тела (ГШТ);
— ударному индексу — частное
от деления ударного объема (УО) на ППТ.
Производительность сердца
определяется:
— величиной преднагрузки.
В соответствии с законом Франка — Старлинга, чем больше растянуто сердце в
период диастолы, тем выше УО. О величине преднагрузки с известной долей
вероятности можно судить по величине давления заклинивания легочных капилляров
(ДЗ), которое коррелирует с давлением заполнения левого желудочка (r = 0,7).
В норме ДЗ = 8—10 мм Hg. При невозможности измерить
ДЗ допустимо принять ее равной диастолическому давлению в легочной артерии
минус 2 мм Hg. Следует учитывать, что часто используемая в клинике для этой цели величина
центрального венозного давления (ЦВД) совпадает с величиной давления заполнения
левого желудочка только в 30% случаев. Гиповолемия приводит к уменьшению, а
гиперволемия — к увеличению преднагрузки. Регулируя емкость венозного звена
большого круга кровообращения с помощью, например, нитроглицерина, можно
изменять величину преднагрузки;
— величиной постнагрузки,
которая зависит от тонуса артериального колена большого круга кровообращения и
выражается через величину общего периферического сопротивления (ОПС).
Последняя рассчитывается по следующей формуле:

В норме ОПС составляет
1500—1700 (дин/сек/см5). Регулируя ОПС с помощью нитропруссида или
допамина (адреналина и т.д.), можно изменять величину постнагрузки.
— ЧСС;
— сократимостью миокарда (определяется состоянием
сердечной мышцы).
Кровь, притекающая к
миокарду, имеет насыщение 95—100%, оттекающая — в коронарном синусе — около
30%. Содержание кислорода в артериальной крови определяется количеством гемоглобина
(НЬ), его насыщением кислородом (SaO2) и парциальным давлением
кислорода (РаО2)
или количеством кислорода, растворенного в плазме. Как правило, в клинике
последней величиной можно пренебречь. Учитывая, что у больных ИБС уровень Hb, как
правило, не изменен, а величина экстракции кислорода и так максимальна,
единственньм путем увеличения ТмО2 является увеличение коронарного кровотока.
Потребление кислорода
миокардом трудно определить в клинических условиях, однако очевидно, что его
величина определяется следующими параметрами:
— систолической работой
сердца,
которая, в свою очередь, является производной ЧСС, АД и УО;
— сократимостью миокарда. Данный показатель не зависит
от пред- и постнагрузки и является производной состояния миокарда. Регулируется
симпатической нервной системой. Позитивные инотропные препараты (сердечные
гликозиды, допамин и др.) увеличивают MVO2, тогда как В-адреноблокаторы
(пропранолол), блокаторы кальциевых каналов (нифедипин) практически все общие
анестетики: в/в (барбитураты, пропофол) и ингаляционные анестетики (изофлюран,
десфлюран, севофлюран) уменьшают указанный показатель;
— величиной напряжения (растяжения) стенок желудочков
сердца. В соответствии с законом Лапласа, величина растяжения стенки сферы
(желудочка) пропорциональна радиусу, таким образом, увеличение объема желудочка
приводит к напряжению его стенок и MVO2 возрастает.
Косвенно о величине
потребления кислорода миокардом можно судить по разности SpO2 и SvO2. Последнюю величину
определяют либо на основании исследования газового состава проб крови, взятой
из коронарного синуса, либо на основании мониторинга обсуждаемого показателя с
помощью фиброоптического катетера, опять-таки установленного в коронарном
синусе.
Принципиально увеличить
коронарный кровоток можно следующими путями:
— увеличив перфузионное
давление за
счет роста системного давления (например, применения а-адреноагонистов);
— увеличив содержание
кислорода в артериальной крови (СаО2) с помощью увеличения содержания Hb или
его (Hb) насыщения (см. предыдущую главу);
— уменьшив ЧСС с помощью В-адреноблокаторов
или наркотических препаратов. Это, в свою очередь, приводит к увеличению
диастолы и к возрастанию коронарной перфузии;
— уменьшив
конечно-диастолическое давление (КДД) желудочков за счет уменьшения
конечно-диастолического объема (КДО), например при использовании
нитроглицерина;
— увеличив сократимость, например за счет применения
инотропных препаратов (добутамин);
— применив кардиопротекторы, например, показано, что
использование неотона (креатин фосфат) повышает УИ. И хотя механизм данного
феномена пока неизвестен (по современным представлениям), креатин фосфат не
способен проникать через неповрежденную мембрану кардиомиоцита и,
следовательно, не должен влиять на метаболизм и сократимость миокарда),
клинические и экспериментальные данные убеждают нас в эффективности данного
препарата;
— примененив
внутриаортальную контрпульсацию, которая увеличивает АДдиа и соответственно
коронарный кровоток;
— наконец, при тяжелой
левожелудочковой недостаточности может быть предпринята попытка временного
протезирования функции левого желудочка за счет обходного шунтирования. При
этом миокард работает практически только «на себя».
Пациенты с ИБС, как правило,
очень лабильны и требуют очень внимательного отношения и тщательно подобранной
предоперационной терапии. Последняя обычно продолжается до момента операции,
более того, больные имеют с собой нитраты вплоть до начала вводного наркоза.
Исключением являются:
— длительно действующие В-блокаторы;
— диуретики;
— препараты дигиталиса.
Данные препараты отменяют с
таким расчетом, чтобы их действие прекращалось к началу операции.
При выборе метода анестезии
следует иметь в виду, что у больных с ИБС риск выполнения операций на грудном
отделе аорты, например, в 3—4 раза выше, чем у пациентов, не страдающих ИБС.
Мнение о предпочтительном
использовании у данной категории больных регионарных методов анестезии
представляется ошибочным. В целом, по-видимому, при грамотно проведенной общей
анестезии не больше риска, чем при грамотно проведенном регионарном
обезболивании, и наоборот. Вопрос выбора в каждом конкретном случае решается
индивидуально и в большей степени зависит от вида и объема предстоящей
операции.
ПРИОБРЕТЕННАЯ ПАТОЛОГИЯ КЛАПАНОВ СЕРДЦА
Ревмокардит является
наиболее частой причиной поражения клапанного аппарата сердца, однако
бактериальный эндокардит, даже после экстракции зуба, может привести к
патологическим изменениям клапанов. В этой связи всем больным, оперируемым на
клапанном аппарате сердца, рекомендуется профилактическое назначение
антибиотиков в пред-, интра- и послеоперационном периоде. Исключение
составляют больные с пролапсом митрального клапана без регургигации, пациенты с имплантированным
кардиостимулятором или дефибриллятором, профилактическая антибиотикотерапия
которым не проводится. Наиболее часто ревмокардит поражает митральный клапан,
реже — аортальный и трикуспидальный.
Митральный
стеноз
Этиология
Чаще всего ревматическая, как
и для большинства приобретенных пороков сердца. В патофизиологии порока имеют
значение:
— увеличение давления в левом
предсердии и перерастяжение его стенок вследствие увеличенного давления заполнения
часто приводят к развитию фибрилляции предсердия и мерцательной аритмии;
— увеличенное давление в
системе легочной артерии и венах приводит к стойкой легочной гипертензии;
— увеличенное давление в
легочной артерии приводит к развитию правожелудочковой недостаточности со снижением
сердечного выброса и трикуспидальной недостаточностью;
— тахикардия, которую больные
плохо переносят тахикардию, так как в указанном случае уменьшаются время диастолы,
объем заполнения левого желудочка и, соответственно, сердечный выброс.
При подготовке к анестезии
необходимо учитывать, что если пациент склонен к тахикардии, то следует
поддерживать адекватный уровень сердечного выброса, лучше всего с помощью
препаратов дигиталиса и В-адреноантагонистов, прием которых продолжают
до момента операции. Гипотония у данной категории больных редко связана с
гиповолемией, и поэтому лечить ее следует препаратами ряда допамина.
Премедикация должна быть
достаточной, но не чрезмерной из-за опасности уменьшить и без того низкие АД и
сердечный выброс.
Недостаточность
митрального клапана
Помимо ревматизма, в
этиологии порока может иметь значение инфаркт с захватом папилярной мышцы и
эндокардит.
Регургитация на митральном
клапане приводит к выбросу крови в левое предсердие в момент систолы.
Перегрузка левых отделов сердца приводит к развитию левожелудочковой недостаточности.
Возникает состояние, при котором давление заполнения левого предсердия
увеличено, а сердечный выброс снижен. Больные лучше переносят тахикардию
(уменьшается объем заполнения левого желудочка), чем брадикардию (увеличенный
объем — увеличенная регургигация).
Аортальный
стеноз
В основе развивающегося
стеноза аортального клапана лежит прогрессирующий кальциноз створок с их
сращением, прогрессирующее сужение аортального отверстия, увеличение растяжения
стенок левого желудочка и их гипертрофия. Для врожденного аортального стеноза
характерно так называемое постстенотическое расширение — увеличение диаметра
корня аорты с истончением створок. У подобных больных особенно недопустимо
повышение АД — это грозит опасностью разрыва истонченных стенок аорты.
Для обеспечения адекватного
сердечного выброса развивается критическое напряжение миокарда левого
желудочка. Из-за возросшей массы миокарда, увеличения внутрижелудочкового
давления и уменьшения системного диастолического давления ишемические атаки
могут возникать даже при непораженных коронарных артериях.
Симптомы болезни нарастают по
мере прогрессирования заболевания. Без операции прогноз неблагоприятный: продолжительность
жизни после появления признаков ИБС — 5 лет, после возникновения
недостаточности кровообращения — 2 года.
В предоперационном периоде
очень важно стараться сохранить синусовый ритм и адекватную преднагрузку.
Нельзя допускать даже коротких эпизодов гипотонии, так как это может привести
к снижению коронарной перфузии и развитию ИМ. Больные с аортальным стенозом в
равной степени плохо переносят тахикардию (уменьшается перфузионное давление и
увеличивается потребление кислорода миокардом) и брадикардию (уменьшение
сердечного выброса).
Следует иметь в виду, что для
обеспечения адекватного сердечного выброса может быть необходимо более высокое
давление заполнения левого желудочка, чем это принято в норме (желательно
устанавливать катетер Сван-Ганца для измерения давления в легочной артерии).
При лечении возникшей ишемии
следует очень осторожно относиться к назначению нитратов, так как даже
незначительное уменьшение объема заполнения левого желудочка может привести к
резкому падению сердечного выброса. Препаратами выброса являются В-адреноблокаторы.
Аортальная
недостаточность
Этиология
Чаще всего ревматизм, реже —
эндокардит, травма и процессы, приводящие к расширению корня аорты (синдром
Марфана, сифилис).
Патогенез порока —
компенсаторная гипертрофия, увеличение объема давления в левом желудочке. По
мере прогрессирования заболевания наблюдается уменьшение АДдиа, вследствие
чего могут появляться признаки ишемии миокарда. Начало заболевания
бессимптомно, и признаки болезни нарастают по мере прогресса нарушения
кровообращения.
В предоперационном периоде
необходимо добиться нормализации ЧСС (допустима незначительная тахикардия) и
поддерживать коронарную перфузию на адекватном уровне. Возможна терапия
вазодилататорами (нитропруссид Na) для снижения постнагрузки
и уменьшения конечно-диастолического давления левого желудочка.
Сочетанное
поражение клапанов сердца
Довольно часто приходится
сталкиваться с ситуацией, когда больной имеет не изолированное поражение одного
из клапанов сердца, а сочетанное: митрально-аортальный,
митрально-аортально-трикуспидальный порок сердца.
Естественно, сочетанное
поражение клапанов существенно ухудшает состояние больного и прогноз
хирургического вмешательства. Клиническая картина определяется преобладанием
гемодинамических сдвигов одного из пороков или носит сочетанный характер.
При серьезных расстройствах
гемодинамики и возможности отложить операцию по поводу инконкурентного
заболевания целесообразно сначала произвести вмешательство с целью коррекции
клапанного аппарата сердца.
Идеопатический
гипертрофический субаортальный стеноз
Врожденное заболевание,
этиология которого неизвестна. Суть порока заключается в гипертрофии
межжелудочковой перегородки, постепенно приводящей к обструкции выводного
тракта левого желудочка во время систолы.
Клинические проявления
идентичны описанным для аортального стеноза. В ходе предоперационной
подготовки следует стремиться:
— поддерживать синусовый
ритм. При возникновении пароксизма суправентрикулярной тахикардии проводят
кардиоверсию;
— продолжать прием В-адреноблокаторов
или антагонистов кальциевых каналов в подобранной дозе до момента операции;
— необходимо поддерживать
высокий уровень преднагрузки и не допускать гипотонии (применение а-адренопозитивных
препаратов);
— инотропные
препараты должны использоваться очень осторожно из-за опасности усугубить
степень стеноза выводного отверстия левого желудочка и провоцирования аритмий.
ВРОЖДЕННЫЕ
ПОРОКИ СЕРДЦА
Пациенты с врожденными
пороками сердца могут и должны быть разделены на больных с некоррегированным
пороком и больных после паллиативного или радикального вмешательства.
Больные после радикальной
коррекции коарктации аорты, незаращения баталова протока, дефекта
межпредсердной перегородки, которым предстоит внекардиальная операция, могут
считаться условно здоровыми. В то же время пациенты после коррекции дефекта
межжелудочковой перегородки (ДМЖП), тетрады Фалло и т.д., особенно если
операция была проведена в относительно поздние сроки, могут иметь серьезные
системные расстройства, способные существенно повлиять на риск предстоящей
операции (например, легочную гипертензию или правожелудочковую недостаточность).
Больные после паллиативной
операции (например, после наложения аорто-легочного анастомоза при тетраде
Фалло) имеют лучшие шансы, чем больные с некоррегированным пороком, однако прогноз нового,
внекардиального вмешательства у данной категории пациентов тем не менее
существенно хуже, чем у лиц без подобной патологии. Необходимо иметь в виду следующее:
— из-за наличия
внутрисердечных шунтов резко возрастает опасность воздушной эмболии в сосуды
большого круга кровообращения. В этой связи с особой осторожностью необходимо
следить за венозными магистралями;
— пациенты с выраженным
цианозом, как правило, имеют компенсаторную гипергемоглобинемию, что
увеличивает опасность тромбозов;
— больные, страдающие
пороками «синего» типа (т.е. имеющие внутрисердечный шунт с преобладанием
право-левого сброса крови), как правило, более устойчивы к гипоксии, чем лица,
не имеющие порока сердца;
— ИВЛ у больных с
врожденными пороками сердца приводит к увеличению внутрисердечного и
внутрилегочного шунтирования крови, в связи с чем SpO2 у пациентов с тетрадой
Фалло = 80—85% может считаться нормой;
— все пациенты этой группы
имеют повышенную опасность развития бактериального эндокардита, и потому им
необходима профилактическая антибиотикотерапия.
В каждом конкретном случае
требуется строго индивидуальная предоперационная подготовка и обследование.
Желательна консультация педиатра и кардиохирурга.
ОСОБЕННОСТИ ПРЕДОПЕРАЦИОННОЙ ПОДГОТОВКИ У
ЛИЦ С ИМПЛАНТИРОВАННЫМ ЭЛЕКТРОКАРДИОСТИМУЛЯТОРОМ ИЛИ ДЕФИБРИЛЛЯТОРОМ
В настоящее время в нашей
стране значительно увеличилось количество людей с имплантированным
электрокардио-стимулятором (ЭКС). Среди множества моделей стимуляторов
(пейсмекеров) следует различать: непрерывные, синхронизируемые и
программируемые.
Непрерывные ЭКС генерируют
заданную частоту импульсов вне зависимости от собственной электрической
активности сердца и потому могут эффективно работать только у лиц с полной
атриовентрикулярной блокадой (как возникшей вследствие заболевания, так и
искусственно вызванной, например, после электродеструкции атриовентрикулярного
(a.-v.) соединения).
Синхронизируемые ЭКС
способны анализировать собственный ритм пациента и генерировать импульс только
в случае неэффективности или недостаточной частоты сердечных сокращений у
пациента.
Программируемые ЭКС способны
изменять режим стимуляции в зависимости от вида нарушения ритма у пациента и
даже увеличивать частоту стимуляции при физической нагрузке
(частот-адаптируемые).
Электрокардиостимуляторы
различают также по местоположению стимулирующего электрода (предсердные,
желудочковые, двухкамерные и т.д.).
При предоперационном
обследовании необходимо выяснить:
— болезнь или симптомы,
послужившие основанием для имплантации ЭКС;
— тип ЭКС и время его
имплантации;
— нынешнее состояние пациента
и функцию сердечно-сосудистой системы;
— зависимость от ЭКС:
работает ли стимулятор постоянно или включается (и как часто) эпизодически.
Большая часть сокращений сердца инициируется собственным ритмом или
навязывается ЭКС; при необходимости проводят холтеровское мониторирование;
— если предполагается
канюляция легочной артерии, необходимо провести флуороскопию, чтобы убедиться в
правильном положении электрода после манипуляции.
Во время операции
необходимо:
— расположить заземление
электрокаутера как можно дальше от прибора (ЭКС), например закрепить пластину
на ноге;
— проводить пульсоксиметрию,
желательно внутрипищеводной доплероэхокардиографии или прямого измерения АД
(для оценки эффективности работы пейсмекера);
— при возможности подключать
электрод к наружному ЭКС и устанавливать последний в режим постоянной стимуляции,
так как в режиме «demand» ЭКС будет отзываться на импульсы, генерируемые
электроножом. При невозможности выполнения указанной процедуры необходимо
предусмотреть два пути: первый — предупредить хирургов о предельном сокращении
периодов использования электрокаутера, второй — отключить постоянный ЭКС и
воспользоваться на время операции временным пейсмекером через эндопищеводный
или трансвенозный (эндокардиальный) электрод.
Если необходимость в
искусственном водителе ритма возникает в ходе оперативного вмешательства,
анестезиолог должен быть готов к следующему:
— проведению наружной ЭКС
через «ложки» дефибриллятора — большинство импортных дефибрилляторов обладают
подобной возможностью;
— экстренной установке
транспищеводного зонда и проведению транспищеводной стимуляции;
— установке трансвенозного
(эндокардиального) электрода.
У некоторых пациентов с
высоким риском развития внезапной сердечной смерти производится имплантация
дефибриллятора. Как правило, один электрод располагают на правом желудочке,
другой — на верхушке сердца. Само устройство подшивают в области живота. Одни
и те же электроды используются для регистрации ритма и производства разряда.
При возникновении желудочковой тахикардии или фибрилляции желудочков устройство
производит разряд мощностью 20— 30 Дж.
При подготовке и проведении
анестезии соблюдают те же предосторожности, что и у больных с ЭКС. Кроме того,
необходимо помнить, что устройство может сработать и от обычного
рентгеновского аппарата. В этой связи на время операции прибор лучше
инактивировать и воспользоваться наружным дефибриллятором, который у подобных
пациентов должен быть всегда наготове.
Определенное негативное
влияние на исход оперативного лечения у лиц, страдающих заболеваниями сердца,
оказывают курение, избыточный вес и сопутствующие заболевания сосудов.
Осложняют прогноз сахарный диабет и генетическая предрасположенность (указания
в анамнезе на родственников, погибших в результате внезапного сердечного приступа).
Возраст также является фактором риска, однако лишь в той степени, в которой
связан с уменьшением устойчивости миокарда к стрессам, физической нагрузке и
снижением чувствительности к действию лекарств.
Общий осмотр больного
отличается более пристальным вниманием к жалобам и симптомам, позволяющим
оценить состояние
сердечно-сосудистой системы. Тщательно выясняют характер болей (давящие,
жмущие за грудиной наиболее характерны для стенокардии), их иррадиацию
(иррадиация в левую руку характерна для ишемии передней, правую руку и спину —
заднебоковой стенки сердца). Положительная реакция на прием нитроглицерина
подтверждает диагноз стенокардии.
Инструментальные
и лабораторные методы исследования
Помимо обычного обследования
необходимо проведение следующих исследований:
— на первом месте стоит ЭКГ
в 12 отведениях;
— стресс-тест. Весьма информативный метод
для оценки наличия скрытой ИБС и определения резервных возможностей миокарда.
Может быть заменен на исследование ЭКГ при транспищеводной электростимуляции;
— холтеровский мониторинг
ЭКГ — также весьма чувствительный тест, позволяющий выявить эпизоды
смещения сегмента ST, в том числе и в ночное
время;
— эхокардиография.
Очень информативный, неинвазивный метод оценки сократимости миокарда, позволяющий
увидеть сокращения отдельных элементов сердца (стенок желудочков, перегородки),
выявить аневризму сердца;
— векторкардиография.
В настоящее время фирмой Hewlett-Packard (США) разработан монитор,
который на основе векторкардиографии и анализа смещения сегмента ST с
высокой степенью достоверности позволяет диагностировать ишемию миокарда;
— радиоизотопные методы
исследования. Позволяют оценить сердечный выброс и обнаружить зоны ишемии.
Достаточно информативный метод;
— рентгеновентрикулография
и контрастное исследование коронарных артерий. До настоящего времени
является наиболее информативным методом, позволяющим одновременно оценить
анатомию и функциональное состояние сердца, внутрисердечную гемодинамику.
Однако ввиду инвазивности и известного риска исследования рекомендуется только
больным, которым предполагается операция на сердце.
Конечно, нет необходимости
проводить каждому пациенту с заболеванием сердца весь описанный объем
исследований, тем более что некоторые из них дублируют друг друга. Объем
исследований определяется в каждом конкретном случае в зависимости от
состояния больного и предстоящей операции. В неординарных случаях при
экстракардиальных операциях у больных с ИБС к обследованию привлекается
специалист-кардиолог, который помогает определить объем предстоящих исследований
и подобрать соответствующую терапию.
Для предупреждения осложнений
со стороны сердечно-сосудистой системы необходимо учитывать факторы риска.
Сердечная недостаточность. Наиболее грозное состояние в
плане возможного развития осложнений в интра- и раннем послеоперационном
периодах. Может привести к развитию инфаркта миокарда или тяжелой
левожелудочковой недостаточности (отеку легкого и т.д.). Больной считается
условно неоперабельным при сердечном индексе (СИ) меньше 2 л/(мин-м2)
и фракции выброса менее 40%;
Ишемия миокарда
(стенокардия).
В нашей стране принято различать стенокардию напряжения и стенокардию покоя и
напряжения. По-видимому, более правильно говорить о стабильной и нестабильной
стенокардии. Нестабильная стенокардия плохо поддается медикаментозной терапии
и гораздо более опасна в плане возникновения интраоперационных осложнений.
Впервые выявленная стенокардия должна расцениваться как нестабильная.
Следует помнить о так
называемых эквивалентах стенокардии, т.е. состояниях, когда ишемия миокарда
манифестирует в виде приступа одышки, аритмии или отека легких. До 30%
инфарктов миокарда (ИМ) протекает бессимпгомно и выявляется только
электрокардиографически. В то же время при холтеровском мониторинге у 50%
пациентов со стабильной стенокардией выявляются кратковременные периоды
ишемии.
Ишемия миокарда — состояние,
при котором возникает несоответствие между потреблением кислорода миокардом и
его транспортом. Если состояние своевременно не диагностировано и не начата
соответствующая терапия, может развиться инфаркт миокарда.
Клиника
Пациенты, находящиеся в
состоянии бодрствования, могут предъявлять жалобы на характерные сжимающие боли
за грудиной с иррадиацией в плечо или руки. Как уже говорилось, следует
помнить, что до 30% ИМ протекает под маской иных заболеваний или в безболевой
форме. Особенно часто бессимптомные формы ишемии миокарда встречаются у
пациентов с сахарным диабетом. У пациентов, находящихся под наркозом, ишемия
может проявляться в виде нестабильной гемодинамики и изменения ЭКГ.
Изменения ЭКГ при ишемии
миокарда.
При субэндокардиальной ишемии наблюдается смешение сегмента ST
более чем на 1 мм ниже изолинии, или инверсия зубца Т. Смещение сегмента
ST вверх от изолинии характерно для трансмурального ИМ. При диагностике
необходимо исключить электролитные расстройства, так как гипо- и гиперкалиемия
могут вызывать сходные изменения ЭКГ.
Другие признаки ишемии
миокарда:
— гипотония;
— внезапное и необъяснимое
иными причинами увеличение давления заклинивания легочных капилляров;
— нарушение подвижности
стенки желудочка при проведении эхокардиографии.
Лечение
— коррекция гипоксемии и
анемии любыми доступными средствами;
— инфузия нитроглицерина с
начальной скоростью 0,5 мкг/(кг/мин); нитроглицерин уменьшает, конечно,
диастолическое давление и объем в желудочках и таким образом уменьшает
потребление кислорода миокардом; некоторое снижение сопротивления в коронарных
артериях под влиянием нитроглицерина увеличивает транспорт кислорода к миокарду;
— дробное введение В-антагонистов
— эсмолол (5—10 мг), обзидан (0,5—1,0 мг); препараты указанной группы снижают
потребность миокарда в кислороде за счет уменьшения ЧСС и сократимости;
— если ишемия сопровождается
гипотонией и снижением сердечного выброса (кардиогенный шок), показано
применение инотропных препаратов: допамин (12—30 мкг/мин) или адреналин (1—5
мкг/мин); уменьшают глубину анестезии и тщательно контролируют преднагрузку
миокарда;
— в критической ситуации
может понадобиться контрпульсация.
ИМ в анамнезе. Необходимо знать локализацию
инфаркта и время, прошедшее после острого периода болезни. Знание локализации инфаркта поможет
выявить «свежие» изменения, если они возникнут. Как правило, риск повторного ИМ
значительно ниже у лиц, перенесших его более 4—6 месяцев назад; в связи с этим
плановую операцию целесообразно отложить до указанного срока.
Гипертония. Вопреки распространенному
мнению, сама по себе гипертония не влияет на частоту и характер осложнений,
однако как фактор риска развития ИБС учитывается в предоперационной подготовке
больных.
Аритмии. Аритмии и ритм, исходящий
не из синусового узла, существенно увеличивают риск развития интраоперационных
осложнений.
Синусовая брадикардия. Диагностируется при ЧСС
менее 60 уд./мин. Если данное состояние не является следствием сердечного
заболевания, то гемодинамических сдвигов, как правило, не наблюдается. Вместе с
тем редкий ритм может служить фактором, провоцирующим появление экстрасистол
или желудочковой тахикардии.
Этиология
— Гипоксия.
— Сопутствующее заболевание
сердца: слабость синусового узла, полная поперечная блокада сердца
(атрио-вентрикулярная блокада III степени), острый инфаркт миокарда
(ИМ).
— Неправильная терапия. К
развитию брадикардии может привести передозировка препаратов сукцинилхолинового
ряда, B-антагонистов, блокаторов кальциевых каналов,
сердечных гликозидов и наркотиков.
— Ваго-кардиальные рефлексы
(тракция за брыжейку кишки, прямое сдавление блуждающего нерва при операциях
на шее или органах грудной полости, центральных ответов, связанных с болью,
манипуляциях с синусом Вальсальвы).
— Повышенное внутричерепное
давление.
Лечение
— Коррекция параметров ИВЛ.
— При брадикардии,
развившейся вследствие ваго-кардиальных рефлексов, целесообразно назначение
атропина (0,4—0,8 мг в/в).
— У пациентов с сопутствующим заболеванием сердца терапию начинают с введения атропина, эфедрина и изопротеренола, при необходимости проводят электрокар-диостимуляцию.
Синусовая тахикардия. Состояние, при котором ЧСС
превышает 100 уд./мин. Ритм правильный и редко превышает 160 уд./мин.
Этиология
Синусовая тахикардия
возникает при гиперадреналинемии, гиперкапнии, гипоксии, гипотонии,
гиповолемии, передозировке ряда лекарственных препаратов (например,
панкурониума, атропина, эфедрина), гипертермии (лихорадка), ИМ, эмболии
легочной артерии, злокачественной гипертермии, феохромоцитоме и
тиреотоксикозе.
Лечение
Направлено на устранение
причины, приведшей к развитию тахикардии, и заключается в:
— коррекции параметров ИВЛ;
— углублении анестезии;
— оптимизации сосудистого
объема;
— медикаментозной терапии
(например, наркотические препараты или В-антагонисты). Пациентам с
высоким риском развития нарушений коронарного кровообращения В-антагонисты
назначают профилактически, так как очевидна возможная причина развития
тахикардии.
Блокада сердца. Различают:
— атриовентрикулярную
(а.-в.) блокаду I степени, которая заключается в увеличении времени
атриовентрикулярного проведения до 0,2 мсек и более. При этом каждому
предсердному сокращению соответствует сокращение желудочков (см. рис.3.1).

а.-в. блокада II
степени может быть подразделена на:
— мебиц 1 — чаще всего
является следствием нарушений на уровне а.-в. узла. Наблюдается прогрессивное
удлинение интервала Р—R с выпадением одного сокращения
желудочков, затем цикл вновь повторяется (см. рис 3.2);

Рис. 3.2
— мебиц 2 — возникает при
нарушениях проведения ниже а.-в. узла. Характеризуется выпадением каждого 3-го,
4-го и т.д. сокращения желудочков. Р—R интервал постоянен. Часто
является грозным предшественником полной поперечной блокады сердца (см. рис.
3.3);

Рис. 3.3
— а.-в. блокада Ш степени —
чаще всего является следствием нарушения проведения на уровне пучка Гиса.
Характеризуется полным отсутствием проведения между а.-в. узлом и
желудочками. Предсердия и желудочки сокращаются независимо, с собственной
частотой. При этом наблюдается выраженная брадикардия (< 45 уд./мин) (см.
рис. 3.4).

Рис. 3.4
Лечение
— а.-в. блокада I степени,
как правило, не требует медикаментозной терапии, если не сопровождается выраженной
брадикардией или гипотонией;
— а.-в. блокада П степени;
— мебиц 1 — также не требует специфической терапии, если не сопровождается брадикардией, сердечной недостаточностью или блокадой ножек пучка Гиса. При возникновении гемодинамически значимых расстройств может потребоваться трансвенозная электрокардиостимуляция (ЭКС);
— мебиц 2 может
потребоваться трансвенозная ЭКС;
— а.-в. блокада III степени
— необходима трансвенозная ЭКС;
— временной процедурой может
стать транскутанная ЭКС;
— при внезапно развившейся
блокаде может быть эффективно назначение атропина.
Суправентрикулярная
(наджелудочковая) тахикардия.
Наблюдается при нарушении
проведения на уровне или выше пучка Гиса. Комплексы QRS не изменены (см. рис. 3.5).

Рис. 3.5.
Предсердная экстрасистолия. Регистрируется в том случае,
если эктопический очаг возбуждения расположен в предсердии и его возбуждение
возникает раньше следующего импульса из синусового узла. Зубец Р
отличается от зубца нормального сокращения, в то время как Р—R интервал
может быть не изменен. Ранняя предсердная экстрасистола может привести к
появлению абберантного комплекса QRS, и, наконец, если эктопичекое
возбуждение приходится на рефракторный период, сокращение желудочков может отсутствовать. Как
правило, не требует специальной терапии (см. рис. 3.6).

Рис. 3.6
Узловой ритм. Характеризуется наличием
инвертированного зубца Р или вообще отсутствием. Комплекс QRS
не изменен. Появление узлового ритма может бьггь следствием ишемии миокарда,
наблюдается иногда и в норме при ингаляционной анестезии. У пациентов,
сердечный выброс у которых во многом зависит от предсердной надбавки, может
наблюдаться снижение ударного объема и гипотония.
Лечение
— уменьшение глубины
анестезии;
— увеличение
внутрисосудистого объема;
— введение атропина;
— дробное в/в введение
пропранолола (по 0,25 мг);
— применение вазопрессоров
(эфедрин, адреналин, допамин);
— предсердная ЭКС (при
необходимости).
Фибрилляция предсердий. Это неправильньш ритм с сокращениями
предсердий с частотой 350—600 в уд./мин (см. рис. 3.7).

Рис. 3.7
При этом может наблюдаться
как тахи-, так и брадикардия. Данный ритм может наблюдаться вследствие ишемии
миокарда, митрального стеноза, тиреотоксикоза, симпатической стимуляции,
передозировки сердечных гликозидов. Терапия зависит от гемодинамических
сдвигов.
1. При тахикардии и
стабильной гемодинамике целесообразно введение пропранолола (дробно, по 0,5 мг
в/в), эсмоло-ла (дробно, по 0,5 мг в/в) или верапамила (дробно, по 5— 10 мг
в/в).
2. При тахикардии на фоне
нестабильной гемодинамики — кардиоверсия.
Трепетание предсердий. Это неправильньш ритм с
частотой сокращения предсердий 250—350 уд./мин и характерной «зубчатой» кривой
вместо зубца Р на ЭКГ. В сочетании с блокадой проведения 2:1 или 1:1
наблюдается желуд очковая тахикардия с ЧСС — 150 уд./мин (см. рис. 3.8).

Рис. 3.8
Терапия. Дигоксин (если данное
нарушение ритма не является следствием передозировки сердечных гликозидов),
пропранолол, эсмолол, верапамил или кардиоверсия.
Желудочковая аритмия
Желудочковая экстрасистолия. Это состояние, при котором
на ЭКГ регистрируются значительно измененные желудоч-ковые комплексы (см. рис.
3.9).

Рис. 3.9
Если происходит регулярное
чередование нормального и измененного комплекса QRS, говорят о желудочковой бигемении,
если же измененным оказывается каждый третий комплекс, — о тригемении. Редкие
желудочковые экстрасистолы иногда наблюдаются и у лиц со здоровым миокардом. Во
время анестезии появление желудочковых экстрасистол может быть следствием
недостаточной глубины анестезии, гипоксии или гиперкапнии. Они также могут быть
следствием ишемии миокарда или ИМ, гипокалиемии, передозировки сердечных
гликозидов. Особенно опасны залповые, политопные экстрасистолы, увеличивающиеся
в частоте, или так называемые «R на Т» (т.е. когда
зубец R появляется сразу за зубцом Т или даже на самом зубце).
Подобные изменения являются предшественниками перехода в желудочковый ритм,
фибрилляцию или остановку сердца.
Лечение. Заключается в коррекции
параметров ИВЛ, КОС или углублении анестезии. При неэффективности указанных
мероприятий и у лиц со скомпрометированным миокардом целесообразно введение
лидо-каина (1 мг/кг в/в с последующей капельной инфузией со скоростью 1—2
мг/мин).
Желудочковая тахикардия. Весьма грозная форма тахиаритмии,
при которой происходит сокращение желудочков в темпе 150—250 уд./мин (см. рис.
3.10).
Первая помощь — лидокаин и кардиоверсия.

Рис. 3.10
Фибрилляция желудочков. Некоординированные и
гемо-динамически неэффективные сокращения желудочков вследствие хаотичного
чередования очагов возбуждения в желудочках — вариант остановки сердца.
Требует немедленного проведения кардиоверсии и сердечно-легочной реанимации
(см. рис. 3.11).

Рис. 3.11
Синдром
Вольф—Паркинсон—Уайта. Характеризуется наличием дополнительного патологического пути
проведения между предсердиями и желудочками сердца. Как правило, наблюдается
обычное проведение по нормальному пути и ретроградное (от желудочков к
предсердиям) — по патологическому. На ЭКГ регистрируются резко укороченный интервал
P—R и патологический зубец
дельта. Относится к тахиаритмиям (см. рис. 3.12).
Лечение. Состоит из терапии
верапамилом и кардиоверсии. Велик риск развития фибрилляции.

Рис. 3.12
Принято считать, что
экстрасистолия с частотой менее 6 атипичных сокращений в мин не требует
специального лечения. Более частые экстрасистолы, пароксизмы желудочковой
экстрасистолии резко ухудшают прогноз операции.
Предыдущие операции на
сердце.
Повторные операции протезирования клапанов сердца или аортокоронарного
шунтирования (АКШ) существенно утяжеляют прогноз операции, тогда как при
некардиальной хирургии ранее выполненное АКШ является положительным моментом и
не сказывается на общей частоте осложнений и летальности.
Глава
4
ОСОБЕННОСТИ
ПРЕДОПЕРАЦИОННОГО ОБСЛЕДОВАНИЯ И АНЕСТЕЗИОЛОГИЧЕСКОГО ОБЕСПЕЧЕНИЯ ПАЦИЕНТОВ С
ЗАБОЛЕВАНИЯМИ ПЕЧЕНИ
ВЛ.
Виноградов
Печень является одним из
наиболее важных органов, обеспечивающих жизнедеятельность человека, ее образно
называют «биохимической лабораторией» организма.
ФУНКЦИИ ПЕЧЕНИ
Синтетическая
функция
В печени синтезируются:
— многие
высокомолекулярные белки, которым принадлежит основная роль в поддержании
онкотического давления крови, и они же являются основными переносчиками
билирубина, некоторых гормонов и ряда лекарственных препаратов. Поэтому
заболевания печени, приводящие к гипоальбуминемии, могут вызывать
периферические отеки, асцит, гидроперикард и гидроторакс (анасарку), так
называемые безбелковые отеки на фоне гиповолемии. В то же время на фоне
гипопротеинемии увеличивается относительная концентрация «активных» форм
некоторых лекарственных препаратов (барбитураты, бензодиазепины, наркотики), в
норме связываемых белками крови, что, с одной стороны, повышает их
эффективность, с другой — уменьшает период полувыведения. В печени
синтезируется также и а1-гликопротеин — в ответ на воспаление
или стресс. Он связывает многие лекарственные препараты, в том числе мышечные
релаксанты, местные анестетики, В-блокаторы и некоторые наркотики. Таким
образом, клиническая эффективность названных препаратов у пациентов с острой
травмой, ожогами, лихорадкой может быть снижена за счет связывания последних а1-глико-протеином.
— многие ферменты, в
том числе: холинэстераза, псевдо-холинэстераза и неспецифическая холинэстераза,
ответственные за биодеградацию листенона, мивакуриума и некоторых местных
анестетиков. Следует помнить, однако, что в норме образование названных
ферментов во много раз перекрывает их реальную потребность, и только при
снижении белоксинтезирующей функции печени на 75% и более возникает реальная
опасность пролонгирования эффектов этих лекарственных препаратов.
Факторы свертывания крови. Многие факторы свертывания
крови, включая протромбин и фибриноген, синтезируются в печени. Единственным
исключением является VIII. фактор, который
синтезируется клетками эндотелия сосудов. Таким образом, печеночная
недостаточность проявляется в том числе и коагулопатией. Однако следует
помнить, что клинически значимые нарушения свертывающей системы крови
развиваются только после снижения белоксинтезирующей функции печени на 50—70%.
Кроме того, активность некоторых факторов свертывания (II, VII, IX и X)
связана с наличием витамина К. Последний образуется в результате
жизнедеятельности кишечной флоры и может проникать в кровь только в присутствии
желчи. В этой связи нарушение желчеобразующей функции печени или недостаточное
поступление желчи в ЖКТ в связи с обструктивными заболеваниями желчных путей
также приводит к развитию коагулопатий.
Желчь. Состоит из первичной
(синтезируется в печени) и вторичной (образуется из первичной в кишечнике в
результате жизнедеятельности кишечной флоры). Желчь содержит холестерин,
жирные кислоты, белок, углеводы, электролиты и билирубин и является
переносчиком продуктов метаболизма и биодеградации лекарственных препаратов.
Кроме того, желчь является эмульгатором жиров и способствует абсорбции последних
в тонком кишечнике. В этой связи нарушение образования или секреции желчи
приводит к серьезным нарушениям жирового обмена и недостатку жирорастворимых
витаминов (А, К, D и Е).
Гликоген и глюконеогенез. Здоровая печень содержит
гликоген в количестве, достаточном для обеспечения энергетических потребностей
в глюкозе на 10—12 ч. Вслед за этим
потребности в глюкозе покрываются за счет глюконеогенеза — биохимического процесса синтеза глюкозы из
неуглеводных источников. Поскольку планом предоперационной подготовки, как правило,
предусматривается голодание, большинство пациентов нуждаются в глюкозе за 8—10 ч перед операцией.
Выброс стресс-гормонов
(адреналин, норадреналин, кортизол, глюкагон), который начинается до операции и
продолжается во время ее выполнения, стимулирует глюконеогенез и вызывает развитие
гипергликемии.
У пациентов с печеночной
недостаточностью нет достаточных запасов гликогена, снижена чувствительность
рецепторного аппарата к гормонам и снижена способность образования глюкозы. Поэтому
у данной категории больных велик риск развития интраоперационной гипогликемии.
Метаболизм
и детоксикация
Билирубин. Билирубин является конечным
продуктом деградации гемсодержащих субстанций (в основном гемоглобин, но также
миоглобин и цитохром). Обладает выраженными липофильными свойствами и должен
быть связан альбуминами плазмы крови для транспорта в печень. Здесь происходит
его накопление в гепатоцитах, где он связывается с глюкуроновой кислотой и в
таком виде выводится с желчью. Гипербилирубинемия — важный признак заболевания печени или желчевыводящих путей.
Следует различать:
— надпеченочную желтуху.
Данное состояние, как правило, связано с повышенным образованием билирубина
вследствие гемолиза. При лабораторном исследовании увеличивается содержание в
крови прямого (несвязанного) билирубина;
— печеночную, т.е. связанную
с поражением печени, желтуху (цирроз, гепатит). Характерно повышение уровня
непрямого (связанного с белком) билирубина;
— подпеченочную желтуху. Как
правило, подобное состояние развивается вследствие сдавления извне (опухоль
поджелудочной железы) или поражения собственно билиарного тракта
(желчнокаменная болезнь, опухоль печеночных протоков, холедоха, большого
дуоденального сосочка). При лабораторном исследовании обращает внимание
увеличение уровня непрямого билирубина.
Нитраты. Если содержание нитратов
превышает потребности для образования белков и других биомолекул, то последние
«дезаминируются» с образованием аммония, который, в свою очередь, используется
для образования мочевины в печени. В этой связи при печеночной недостаточности
содержание азота мочевины (BUN), как правило, в норме,
тогда как содержание аммиака значительно увеличено. Уровень аммиака часто используют
для определения степени печеночной недостаточности. Однако нет прямо
пропорциональной зависимости между концентрацией аммиака в плазме крови и
выраженностью печеночной энцефалопатии. В этиопатогенезе последней важную роль
играют различные биологически активные амины, способные имитировать действие
нейротрансмиттеров, и у-аминомасляная кислота (ГАМК).
Стероидные гормоны. Печень является тем местом,
где происходит разрушение стероидных гормонов. Таким образом, печеночная
недостаточность приводит к увеличению концентрации в крови альдостерона и
кортизола, следствием чего является повышенная реадсорбция воды и натрия (отеки,
асцит) и экскреция калия. Пониженный метаболизм эстрогенов и замедленное
превращение андрогенов приводят к появлению «печеночных знаков»: «сосудистые
звездочки», покраснение ладоней, геникомастия, атрофия яичек.
Лекарственные препараты:
— наиболее частый механизм
детоксикации связан с окислением под действием неспецифических оксидаз, последующим
связыванием с глицином, глюкуроновой кислотой или образованием сульфгидрильных
групп и выведением с желчью и мочой. Некоторые метаболиты более активны
(преднизолон > преднизон) или имеют
более длительный период полураспада (дисметилдиазепам > диазепам), чем исходный лекарственный препарат, что
необходимо учитывать при назначении данного лекарства лицам с печеночной недостаточностью;
— некоторые лекарственные
препараты (барбитураты, бензодиазепины, кортикостероиды, антигистаминные
средства и т.д.) проявляют специфическое действие или существенно большую
активность только после предварительной обработки ферментами печени. При
увеличении концентрации указанных веществ возрастает и активность
соответствующих ферментов. Таким образом, для проявления специфического эффекта
требуются (ACT), аланин-аминотрансферазы (АЛТ), щелочной фосфатазы
(ЩФ) и уровень билирубина.
Гепатит А. Передается в основном
фекально-оральным путем. Инкубационный период до 2 мес. Смертность составляет
1:1000 чел. Если анестезия и операция проводятся во время инкубационного или
продромального периода, смертность значительно возрастает, достигая 100% при
молниеносной форме.
Гепатиты В и С. Основной путь передачи — с
животными средами (кровью). Смертность значительно выше, чем при гепатите А:
до 5% при гепатите В и 1—3% при гепатите С. Оба этих гепатита могут принимать
хроническое течение с исходом в хронический персистирующий гепатит и цирроз
печени.
Анестезия и операция на фоне
активного гепатита имеют предельно высокий риск.
Анестезия на фоне умеренно
активного хронического гепатита несет повышенный риск и должна проводиться
препаратами, даже потенциально не обладающими гепатотоксичными свойствами.
Холестаз. Манифестирует повышением
активности ЩФ без параллельного увеличения активности трансаминаз. Холестаз
без обструкции желчных путей может быть следствием беременности, перенесенной
анестезии, сепсиса, приема ряда пищевых и лекарственных препаратов (алкоголя,
некоторых контрацептивов, сульфаниламидов, эритромицина).
Хронические заболевания
печени и цирроз. Как правило, являются финальной стадией острых заболеваний печени,
таких, как гепатит, алкоголизм, первичный билиарный цирроз печени, болезнь
Вильсона и др.
Все эти заболевания приводят
к рубцеванию и сморщиванию печеночной ткани, что вызывает увеличение сопротивления
в системе воротной вены. Это, в свою очередь, приводит к развитию портальной
гипертензии и варикозному расширению вен пищевода. Комбинация портальной гипертензии,
нарушения белковосинтезирующей функции печени (снижение содержания альбуминов,
факторов свертывания) создают условия для развития асцита, анасарки,
коагулопатий и кровотечений из различных отделов желудочно-кишечного тракта.
Многие из этих пациентов в финальной стадии заболевания нуждаются в
ортотопической трансплантации печени.
ПРЕДОПЕРАЦИОННАЯ ПОДГОТОВКА ПАЦИЕНТОВ С
ЗАБОЛЕВАНИЯМИ ПЕЧЕНИ
Анамнез,
осмотр, данные инструментальных и лабораторных методов исследования
При сборе анамнеза выясняют,
болел ли пациент гепатитом. Важен социальный анамнез — злоупотребление
алкоголем настораживает в плане развития алкогольного цирроза печени.
При осмотре обращают
внимание на желтуху, печеночные знаки:
— «голова медузы» —
расширенные, ярко выделяющиеся подкожные вены в области живота;
— покраснение ладоней,
— «сосудистые звездочки» —
телеангиоэктазии и т.д. В биохимическом анализе крови на поражение печени указывает
увеличение активности ACT, АЛТ, щелочной фосфатазы
или повышенное содержание билирубина. При возникновении сомнений проводят
изучение активности гепатоспецифических ферментов, например 5'нуклеотидазы.
Чрезвычайно важно оценить нарушения свертывающей системы крови в плане
предупреждения возможных коагулопатических кровотечений.
Анестезиолог принимает во
внимание данные инструментальных методов исследования (компьютерной
томографии, УЗИ и т.д.) в той степени, в которой это может повлиять на объем
предстоящего оперативного вмешательства.
Факторы,
влияющие на риск оперативного вмешательства
Как правило, при оценке
тяжести поражения печени и операционного риска исходят из уровня билирубина в
сыворотке крови. В табл. 4.1 приводится классификация Child, принятая для
характеристики обсуждаемого состояния.
Таблица 4.1 Классификация
тяжести поражения печени по Child
|
Класс |
Признаки |
|
А (невысокий риск) |
Содержание билирубина менее 200 мг/л, концентрация
альбумина — более 35 г/л и отсутствуют асцит или явления энцефалопатии |
|
В |
Содержание билирубина — от 201 до 299 мг/л,
концентрация альбумина от 34 до 31 r/л; умеренный асцит или слабо заметная
энцефалопатия |
|
С (высокий риск) |
Пациенты с высоким риском имеют билирубин более 300
мг/л; альбумин — менее 30 г/л и выраженный асцит или энцефалопатию. |
Существенно повышают риск
оперативного вмешательства варикозно расширенные вены пищевода, особенно если
в анамнезе имеются указания на кровотечения; гипоальбуминемия, снижение уровня
протромбина.
При наличии асцита
целесообразно произвести в дооперационном периоде дозированные зксфузии
жидкости. При экстренной операции лапаротомия и снятие гидроперитонеума могут
привести к резкому падению артериального давления вследствие резкого уменьшения
преднагрузки: кровь активно депонируется в ранее сдавленных венах органов
брюшной полости.
Для снижения операционного
риска необходима тщательная предоперационная подготовка с максимально возможной
коррекцией функциональных показателей печени.
По возможности из-за очень
высокого риска летального исхода следует избегать проведения анестезии лицам с
активным гепатитом.
ОСОБЕННОСТИ АНЕСТЕЗИОЛОГИЧЕСКОГО ПОСОБИЯ
У ПАЦИЕНТОВ С ЗАБОЛЕВАНИЯМИ ПЕЧЕНИ
Нецелесообразно использовать
препараты, хотя бы потенциально обладающие гепатотоксическим действием
(галотан, энфлюран). Проблема гепатита или даже острого некроза печени, связанных с
применением галотана, остается в центре внимания анестезиологов в течение всего
времени использования препарата. Следует иметь в виду, что послеоперационная
печеночная недостаточность чаще всего связана с латентно протекавшим вирусным
гепатитом. Кроме того, большое значение имеет анамнез: велик риск развития осложнений
со стороны печени у пациентов, ранее перенесших наркоз галотаном и отмечавших
лихорадку неясного генеза, транзиторную желтуху, выраженную гиперферменгемию.
Предположительно механизм развития некроза печени под влиянием галотана выглядит следующим
образом. Трифторацетат — продукт биодеградации галотана, адсорбируется
мембранами гепатоцитов и образует аутоантиген, к которому синтезируются антитела,
приводящие в конечном итоге к острой дистрофии печени. По-видимому, в развитии
данного процесса имеет место наследственная предрасположенность, иначе трудно
объяснить, почему осложнения со стороны печени отмечены только в одном случае
на каждые 40 000 анестезий. Случаи острого некроза печени описаны и того реже:
1/250 000 — 1/300 000 анестезий.
Остается непонятным
отсутствие этой проблемы у детей. Учитывая изложенное выше,
можно согласиться со следующими показаниями к применению галотана:
— общая анестезия у детей;
— наличие обструктивных
заболеваний верхних дыхательных путей.
Галотан с осторожностью
должен применяться повторно, особенно ранее 6 недель после предшествующей
анестезии.
Галотан противопоказан
пациентам с заболеваниями или подозрением на заболевание печени и в случае,
если при ранее проводимых анестезиях отмечена реакция на галотан.
Необходим тщательный контроль
проходимости дыхательных путей из-за повышенного риска аспирации. При прочих
равных условиях целесообразно предпочесть интубационный наркоз с обязательной
постановкой желудочного зонда.
Из-за снижения тонуса сосудов
большого круга кровообращения и паралитически открытых артериовенозных шунтов
у данной категории больных, как правило, резко снижено ОПС. В этой связи во
время операции возможно падение артериального давления. Необходимо
предусмотреть возможность введения инотропных препаратов.
Следует помнить об
особенностях фармакокинетики и фармакодинамики ряда препаратов при печеночной
недостаточности (см. выше).
Особенно тщательно следует
продумать тактику инфузионно-трансфузионной терапии, так как у больных с
поражением печени, как правило, имеются серьезные нарушения водно-электролитного
состава на фоне гипоальбуминемии и низкой осмолярности. Необходим прецизионный
лабораторный контроль кислотно-основного состояния и содержания белка в
сыворотке крови.
Следует помнить, что при
печеночной недостаточности велик риск перехода ее в полиорганную
недостаточность как минимум печеночно-почечную, поэтому необходим постоянный
контроль диуреза.
При проведении анестезии у
лиц в финальной стадии печеночной недостаточности следует иметь в виду, что при
энцефалопатии происходит накопление эндогенных субстанций типа ГАМК и, таким
образом, потребность в общих анестетиках у данной категории больных снижена.
Учитывая нарушенную гликогенсинтезируюшую функцию печени, пациенты этой категории
должны получать постоянную инфузию растворов глюкозы. Необходим
интраоперационный контроль сахара крови.
Печеночный кровоток
снижается под влиянием анестезии и операционного стресса. В целом степень
снижения печеночного кровотока пропорциональна снижению системного давления.
Таким образом, все факторы (гиповолемия, использование вазоактивных
препаратов, В-блокаторов и т.д.), влияющие на системный кровоток,
вызывают и изменения регионарного кровотока в печени.
НАРУШЕНИЕ ФУНКЦИИ ПЕЧЕНИ В
ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ
Нарушения функции печени не
так уж редки в раннем послеоперационном периоде и могут протекать в виде
транзиторной ферментемии или же печеночной недостаточности той или иной степени
выраженности.
Действия хирургов могут
вызывать сдавление билиарного тракта или печеночной связки, приводя к ишемии печени.
Чаще всего это является следствием длительного стояния турникета на
гепато-дуоденальной связке. В послеоперационном периоде высока вероятность
тромбоза печеночной артерии и возникновения печеночной недостаточности той или
иной степени выраженности.
Анестезия может усугубить
или спровоцировать развитие латентной печеночной недостаточности (вследствие
скрыто протекающего гепатита, алкоголизма и т.д.).
Глава 5
ОСОБЕННОСТИ
ПРЕДОПЕРАЦИОННОГО ОБСЛЕДОВАНИЯ И АНЕСТЕЗИОЛОГИЧЕСКОГО ОБЕСПЕЧЕНИЯ ПАЦИЕНТОВ С
ЗАБОЛЕВАНИЯМИ МОЧЕВЫДЕЛИТЕЛЬНОЙ СИСТЕМЫ
Н.В.
Озерова
ФУНКЦИЯ
ПОЧЕК
Почки играют весьма важную
роль в процессах поддержания постоянства водно-электролитного баланса
организма и выведения токсичных продуктов. Это достигается за счет
функционирования следующих систем:
— система «ренин —
ангиотензин
— альдостерон». Почки секретируют ренин в ответ на гипоперфузию ткани,
гипергидратацию (уменьшение концентрации ионов натрия) и увеличение
симпатической активности. Ренин активирует процесс превращения
ангиотензиногена в ангиотензин I, который в легких переходит в активную форму —
ангиотензин II. Ангиотензин II приводит к артериальной
вазоконстрикции и стимулирует выброс альдостерона. Альдостерон — гормон, относящийся
к группе минералокортикоидов, — вырабатывается корковым слоем надпочечников,
способствует реадсорбции ионов натрия в дистальных клубочках, регулируя K+/Na+ обмен. Выброс альдостерона
стимулируют адренокортикотропный гормон (АКТГ), ангиотензин II,
высокий уровень K+ и низкий уровень Na+
— антидиуретический гормон (АДГ) вырабатывается в
задней доле гипофиза и уменьшает экскрецию воды почками, делая мочу более
концентрированной. Гиперпродукция АДГ возникает в ответ на гиперосмолярность
крови, уменьшение внеклеточного объема, а из врачебных манипуляций — в ответ
на хирургический стресс и ИВЛ;
— атриальный
натрийуретическнй фактор (АНФ) вырабатывается в ушке предсердий при их чрезмерном
растяжении (гиперволемия). АНФ вызывает увеличение диуреза и действует как
антагонист системы «ренин — ангиотензин — альдостерон»;
— простогландины (PGE2,
PGI2) и кинины вырабатываются в ответ на стресс и гиперпродукцию
ренина. Они вызывают дилатацию почечных сосудов и уменьшение реадсорбции Na+.
Кроме того, почки являются
важным регулятором экстраренальных систем.
Почечный кровоток составляет
20—25% минутного объема кровообращения и регулируется в зависимости от величины
среднего артериального давления.
ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Острая почечная недостаточность (ОПН)
Это резкое снижение функции почек с развитием олигоанурии (продукция мочи менее 25 мл/ч). Почечная недостаточность является грозным осложнением у хирургических и травматологических больных, в 50% случаев заканчивается летальным исходом.
Этиология
Надпочечная (вследствие гиповолемии,
низкого сердечного выброса и т.д.). Как правило, быстрое устранение причины
возникновения ОПН (коррекция ОЦК, лечение синдрома малого выброса) приводит к
быстрому регрессу симптомов, однако при несвоевременном лечении может перейти в
стойкую форму.
Почечная (острый гломерулонекроз).
Возникает вследствие действия надпочечных факторов, приема нефротоксичных препаратов,
системных сосудистых заболеваний, острого гломерулонефрита.
Послепочечная связана с обструкцией
мочевыводящих путей (почечно-каменная болезнь, болезни предстательной железы и
т.д.) (табл. 5.1).
Таблица 5.1
Некоторые
дифференциально-диагностические признаки уровня возникновения ОПН
|
|
Надпочечная |
Почечная |
Послепочечная |
|
Моча (Na+ |
< 10 мэкв/л |
> 20 мэкв/л |
> 20 мэкв/л |
|
Моча (СГ) |
< 10 мэкв/л |
> 20 мэкв/л |
|
|
Осмолярность мочи |
>500 |
<350 |
<350 |
|
Мочевина (моча/плазма) |
>8 |
<3 |
<3 |
|
BUN/креатинин плазмы |
>20 |
=10 |
=10 |
Клиника
— гиперволемия (вследствие
нарушенной выделительной функции почек) и гипонатриемия («разведение») приводят
к развитию гипертензии и периферических отеков;
— возможно развитие
гиповолемии вследствие потери концентрационной функции почек;
— задержка К+;
— увеличение уровня
креатинина, BUN, мочевины;
— снижение удельного веса
мочи.
Хроническая
почечная недостаточность (ХПН)
Она характеризуется
постепенным снижением фильтрационной способности почек с нарастанием содержания
в плазме крови азотистых шлаков: креатинина, мочевины, BUN. Возможна длительная
компенсация.
Этиология
Наиболее частыми причинами,
вызывающими развитие ХПН, являются: гипертоническая болезнь, гломерулонефрит и
некоторые другие состояния.
Клиника
— гиперволемия и гипертензия,
приводящие к развитию острой сердечной недостаточности и отекам;
— быстро прогрессирующий
атеросклероз, который увеличивает риск развития ишемической болезни сердца;
— уремический перикардит;
— изменения ЦНС, начиная с
энцефалопатии и заканчивая уремической комой. Часто наблюдаются и
полинейропатии;
— гиперкалиемия,
гипермагнеземия и гипонатриемия;
— метаболический ацидоз
(вследствие нарушения выведения кислых продуктов обмена);
— хроническая анемия,
развивающаяся вследствие нарушения образования эритропоэтина и пониженной
толерантности эритроцитов к повреждающим воздействиям;
— нарушение свертываемости
крови;
— увеличение объема желудка,
повышенная кислотность и замедление опорожнения желудка, что сопровождается
тошнотой, рвотой и повышенным риском язвообразования в ЖКТ;
— повышенная
чувствительность к инфекционным заболеваниям (без проведения
иммуномодулирующей терапии);
— измененная фармакодинамика
многих лекарственных препаратов вследствие изменения соотношений объемов в
различных водных бассейнах, сдвигов рН, электролитного состава крови, общего
белка и т.д.
Лечение
Диализ показан больным с ОПН и ХПН
в случаях развития гиперкалиемии, объемной перегрузки, азотемии, наличия
уремических осложнений.
Гемодиализ. Основан на использовании
полупроницаемой мембраны и диализных растворов. Вследствие искусственно
созданного градиента концентраций происходит фильтрация крови. Требует наложения
артериовенозной фистулы. Проводится обычно 2—3 раза в неделю. Из наиболее
частых осложнений следует отметить нарушение водно-электролитного баланса,
гипотензию и гипоксию. Необходимо помнить, что результат диализа становится
очевидным через 5—6 ч после его окончания (время перераспределения веществ и
ионов по водным секторам).
Ультра- и гемофильтрация. При ультрафильтрации применяется
оборудование для гемодиализа без диализных растворов (используется
гидростатическое давление через полупроницаемую мембрану). При гемофильтрации
применяется хорошо проницаемая мембрана и собственное давление пациента.
Перитонеальный диализ. В настоящее время используется
крайне редко. Из незначительного числа преимуществ следует отметить отсутствие
необходимости в гепаринизации, а, следовательно, снижение частоты развития
связанных с ней осложнений и незначительное влияние на макрогемодинамику.
Значительно менее эффективен, чем диализ, гемо- и ультрафильтрация.
ВОДНО-ЭЛЕКТРОЛИТНОЕ
СОСТОЯНИЕ И ЕГО НАРУШЕНИЯ
Вода составляет примерно 60%
веса тела.2/3 воды находится во внеклеточном
пространстве, 1/3 — внутриклеточная вода. Примерно 2/3 внеклеточной воды
находится в интрацеллюлярном пространстве, 1/3 составляет внутрисосудистый
объем.
Ежедневная потребность
организма человека в воде составляет примерно 2500 мл, из них 1400 мл человек
получает с выпиваемой жидкостью, 700 мл — со съедаемой пищей и 500 мл
эндогенной воды образуется в результате метаболизма. Дневные потери
составляют: 1400 мл с мочой, 300 мл с дыханием, 500 мл испаряется с поверхности
тела и 200 мл с каловыми массами. Потери воды возрастают при лихорадке
(примерно 500 мл/град/сут.), употреблении соленой, сладкой и сухой пищи,
антидиуретической терапии, гипергликемии и болезни надпочечников.
Гипокалиемия
Следует различать истинную
гипокалиемию и гипокалиемию, связанную с перераспределением ионов К+
между водными секторами.
Содержание К+ в
плазме слабо отражает истинное содержание ионов К+ в организме, так
как в норме 98% К+ находится внутри клеток. Таким образом,
могут произойти существенные потери К+, прежде чем это
отразится на его содержании в плазме крови. (У человека весом 70 кг снижение
содержания K+ в плазме крови с 4 до 3 мэкв/л при нормальном рН
свидетельствует о реальном дефиците 100— 200 мэкв К+.)
Потери калия происходят
через желудочно-кишечный тракт (диарея, рвота, кишечная непроходимость) или
почки (неконтролируемое применение диуретиков, надпочечниковый криз, ацидоз на
уровне клубочкового аппарата почек).
Нарушения перераспределения
K+ возникают и при алкалозе, вследствие перемещения ионов водорода
из клетки в обмен на перемещение ионов К+ внутрь клетки. Так, к
выраженной гипокалиемии может привести быстрая коррекция ацидоза с помощью
гипервентиляции (ИВЛ) или инфузии гидрокарбоната натрия.
Клинические проявления гипокалиемии возникают при
снижении уровня K+ до уровня менее 3 мэкв/л или при быстром падении
его уровня. Признаки: слабость, нарушения нервно-мышечной проводимости,
повышенная возбудимость миокарда. ЭКГ-признаки гипокалиемии: сглаженность
зубца Т, увеличение интервалов Р—R и Q—Т, появление «корытообразного q-t.
Лечение
Состоит в выяснении причины
заболевания и восполнении уровня K+ (0,2 мэкв/кг/ч в/в). Нет
необходимости коррегировать хроническую гипокалиемию, если уровень К+
> 2,5 мэкв/л перед вводным наркозом, так как быстрая коррекция может создать
больше проблем, чем существующая гипокалиемия. Во время операции следует
постоянно контролировать уровень К+ и при необходимости восполнять
его потери (0,5—1,0 мэкв в/в до нормализации содержания).
Гиперкалиемия
Этиология
— олигоанурия (почечная
недостаточность, гипоальдостеронизм);
— сдвиг в экстрацеллюлярном
секторе (ацидоз, ишемия, миолиз и т.д.);
— инфузия крови, калиевой
соли пенициллина или со-лесодержащих растворов пациентам с почечной недостаточностью;
— массивный гемолиз.
Клинические симптомы:
— включают мышечную
слабость, парестезии, нарушения возбудимости сердца, которые становятся
особенно тревожными при превышении уровня К+ — 7 мэкв/л
(брадикардия, фибрилляция желудочков и даже остановка сердца) — показание для
проведения экстракорпорального диализа;
— ЭКГ-симптомы: высокий
зубец Т, депрессия сегмента ST, исчезновение зубца Р,
удлиненные интервалы Р—R и Q-Т.
Лечение
Зависит от природы нарушений
ЭКГ и уровня K+ в плазме крови:
— изменения ЭКГ купируются
медленным в/в введением 0,5—1,0 г. хлорида кальция. Возможно повторное введение
через 5—7 мин, если сохраняются изменения ЭКГ;
— введение гидрокарбоната
натрия вызывает перемещение калия в интрацеллюлярный сектор, таким образом,
можно вводить повторные дозы NаНСО3 по 50 мэкв
каждые 10—15 мин до нормализации ЭКГ. Следует помнить, что гипервентидяция
вызывает перемещение K+ во внеклеточное пространство;
— глюкоза с инсулином
способствует перемещению K+ в интрацеллюлярное пространство. Вводят
по 16 ЕД инсулина в/в с 20 мл 40% раствора глюкозы каждые 5—7 мин;
— в случае неэффективности
описанной выше терапии следует прибегнуть к гемодиализу.
Гипонатриемия
Это относительное увеличение
воды в организме, гипергидратация.
Истинное количество воды
может быть повышенным, нормальным или даже уменьшенным.
Гипонатриемия может
возникать в результате уменьшения осмолярности плазмы.
При отсутствие прибора,
измеряющего осмолярность, данный показатель можно рассчитать по формуле:
Осмолярность (мОсм) = 2[Na+(мэкв/л)
+K+(мэкв/л)]+ МГ,
где
Мочевина (мг%) Глюкоза
(мг%)
МГ= ———————— + ————————
2,8 18
|
|
Если отмечается рост
концентрации веществ, способных существенно повлиять на осмолярность плазмы
(глюкоза, мочевина, маннитол и т.д), будет отмечаться рост осмолярности
вопреки низкой концентрации К+.
Клиническая картина заключается в
прогрессирующей головной боли, сонливости, переходящей в летаргическое
состояние, а затем, без лечения, в кому. Гипонатриемия выбывает нестабильность
клеток, ухудшение сердечной деятельности, появление аритмии. Данные симптомы
становятся особенно заметны при уровне Na+ меньше 120 мэкв/л или
когда концентрация ионов натрия падает слишком быстро.
Лечение
Зависит от истинного
волемического статуса пациента:
— при истинной гиповолемии,
возникающей вслед за обильным диурезом, рвотой и т.д., необходимо восстановить
должный объем циркулирующей крови (ОЦК) за счет переливания изотонических
растворов кристаллоидов;
— при гиперволемии (почечная
недостаточность, сердечная недостаточность, цирроз) необходимо добиться
адекватного диуреза или провести ультрафильтрацию;
— при нормоволемии
(гиперпродукция АДГ, гипотиреоидизм, прием лекарств, замедляющих выведение
воды, ятрогенная водная перегрузка) необходимо добиться адекватного диуреза без
потери Na+ и К+. Этого можно достичь с помощью аккуратной
трансфузии гипертонического раствора (3%-ный раствор хлорида натрия) или
маннитола (следует избегать резкого увеличения внутрисосудистого объема).
Указанная терапия в состоянии предотвратить появление угрожающих симптомов со
стороны ЦНС или сердечно-сосудистой системы;
— не следует добиваться
полной нормализации уровня натрия, так как большинство симптомов болезни
исчезает после достижения концентрации Na 125 мэкв/л.
Гипернатриемия
Истинное количество воды в
организме (КВО) может быть увеличенным, уменьшенным или нормальным.
Клинические проявления: слабость, неподвижность,
заторможенность, переходящая в кому.
Лечение
Определяется реальным
содержанием воды в организме:
— пациенты с истинной
гиповолемией. Данное состояние возникает в связи с обильной потерей воды
(диарея, рвота, неконтролируемое применение осмотических диуретиков) или неадекватным
восполнением возникших нарушений. При нарушениях гемодинамики или видимых
расстройствах микроциркуляции инфузионную терапию начинают с 0,45% или 0,9%-го
раствора хлорида натрия. После восполнения сосудистого объема дальнейшую
коррекцию проводят 5%-ным раствором глюкозы;
— пациенты с гиперволемией.
Данное состояние может возникнуть вследствие перегрузки натрием в результате
надпочечникового криза, проведения гемодиализа гипертоническим раствором или
инфузией гипертонического раствора и больших объемов бикарбоната натрия.
Избыточный натрий может быть удален с помощью диализа или проведения
диуретической терапии с последующим возмещением потерь воды 5%-ным раствором
глюкозы. Дефицит воды необходимо восполнять особенно осторожно и постепенно у
лиц с хроническим страданием, с тем чтобы избежать развития отека мозга. Обычно
половину дефицита восполняют в первые 24 ч, оставшийся — в последующие 24—48
ч;
— пациенты с нормоволемией.
Данное состояние возникает прежде всего при сахарном диабете. Лечение
заключается в терапии сахарного диабета и восполнении дефицита воды 5%-ным раствором
глюкозы.
ДЕЙСТВИЕ РАЗЛИЧНЫХ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ НА ПОЧКИ
Для лечения гиперволемии,
гиперкалиемии, гипертонии и олигоанурической стадии ОПН чаще всего используют
диуретики, которые можно подразделить на две большие группы:
-
осмотические диуретики (маннитол, 40% глюкоза);
-
неосмотические диуретики (фуросемид, эуфиллин,
диакарб, гипотиазид и т.д).
Допамин в дозах 1—4
мкг/(кг/мин) повышает почечный кровоток и экскрецию воды и Na+ Этот эффект допамина
опосредуется допаминергическими рецепторами почек и связан с уменьшением
органного сосудистого сопротивления. Препарат используется как вспомогательное
средство стимуляции диуреза. Его эффект ослабляется эндогенной системой ренин
— ангиотензин. Из побочных эффектов следует указать на кардиотропное (в дозах
4—8 мкг/(кг/мин) и вазоконстрикторное (в дозах свыше 10 мкг/( кг/мин) действие
допамина.
Препараты,
используемые для анестезии
У пациентов с
нескомпрометированными почками могут наблюдаться транзиторные расстройства
мочевыделительной функции во время анестезии и операции, связанные с
изменениями сердечного выброса или регионарного кровотока в почках на
отдельных этапах операции.
Непрямые эффекты. Ингаляционные анестетики и
барбитураты могут вызывать угнетение сократительной способности миокарда, снижение
МОС и увеличение сосудистого сопротивления в почках. Указанные вещества не
влияют на уровень антидиуретического гормона (АДГ), однако хирургический стресс
сам по себе существенно повышает продукцию АДГ. Объемная нагрузка, проведенная
до вводного наркоза, способна нивелировать описанный эффект хирургического
вмешательства. Спинальная и эпидуральная анестезия вызывают уменьшение
регионарного кровотока в почках и, как следствие, олигурию.
Прямые эффекты. Галогенсодержащие
анестетики обладают нефротоксичностью в той мере, в которой образуют
флуорид-ион во время биодеградации. Степень некроза гломерулярного аппарата
почек зависит от концентрации флуорид-иона в крови и времени экспозиции.
Принято считать, что концентрация 50 мкМоль/л вызывает значимую дисфункцию
почек. Галотан (фторотан) образует флуорид-ион и может вызывать ОПН. Таким
образом, применение препарата у больных с заболеваниями почек относительно
противопоказано.
Энфлюран. только 2% растворенного в
крови энфлюрана распадается с образованием флуоридиона, остальная часть
препарата выводится в неизменном виде. Таким образом, в обычно используемых
дозах максимально возможная концентрация флуорид-иона в крови не превышает 15
мкМоль/л, что существенно ниже обозначенной границы нефротоксичности.
Изофлюран, десфлюран,
севофлюран. Они не образуют флуорид-ион в клинически значимых концентрациях и,
следовательно, нефротоксичностъю не обладают.
При грамотно проведенной
анестезии изменения функционального состояния почек носят транзиторный
характер и легко обратимы. Уже через несколько часов после проведенной
анестезии восстанавливается нормальный режим работы почек. После длительной и
травматичной операции, длительной анестезии и затянувшегося периода ИВЛ
восстановление нормальной функции почек занимает, как правило, несколько дней.
Фармакология препаратов при почечной
недостаточности
Изменения привычной
фармакокинетики и фармакодинамики лекарственных препаратов при почечной недостаточности
может быть обусловлено:
— нарушением распределения
воды между водными секторами;
— уменьшенным содержанием
белка в плазме, отсюда — увеличением биодоступности лекарств, в норме
связываемых белками крови;
— ацидоз приводит к
увеличению концентрации неионизированных лекарств;
— нарушением баланса
электролитов;
— уменьшенной скоростью
биотрансформации;
— уменьшенной скоростью
выведения почками;
— уремией, которая вызывает
депрессию ЦНС и снижает до 50% потребность в седативных препаратах (в зависимости
от глубины поражения).
Некоторые данные о фармакодинамике препаратов, наиболее часто используемых во время анестезии
Препарат |
Химическая характеристика |
Особенности фармакодинамики при ХПН |
|
|
Атропин |
Жирорастворимый |
Элиминируется
почками, при ОПН доза должна быть уменьшена |
|
|
Бензодиазепин, фенотиазины
и бутерофеноны |
Жирорастворимый |
Метаболизируют
в печени с образованием активных и неактивных фрагментов, которые затем
элиминируются почками. 90—95% бензодиазепинов в норме связывается белками
плазмы. С большой осторожностью следует использовать диазепам, так как он
обладает достаточно большим периодом полувыведения, а его метаболиты
биологически активны. Бензодиазепины практически не удается удалить с помощью
гемодиализа |
|
|
Бензодиазепин, фенотиазины
и бутерофеноны |
Жирорастворимый |
Фенотиазины,
вследствие наличия у них свойств а-адреноблокаторов, могут вызывать
уменьшение сердечного выброса и АД, особенно у лиц, ранее подвергавшихся
гемодиализу |
|
|
Барбитураты, этомидад и
пропофол (диприван) |
Жирорастворимый |
Являются
веществами, активно связываемыми альбуминами плазмы крови, поэтому в условиях
гипоальбуминемии при ОПН потребность в данных препаратах снижена. Последнее
связано еще и с метаболическим ацидозом и нарушенной проницаемостью
гемато-энцефалического барьера. Рекомендуется использовать более низкие дозы
для индукции и поддержания анестезии |
|
|
Наркотические аналгетики |
Жирорастворимый |
Метаболизируют
в печени, однако в связи с гипоальбуминемией эффект может быть пролонгирован |
|
|
Катехоламины с
преимущественным действием на а-адренергические рецепторы (адреналин,
норадреналин, эфедрин) |
Ионизированный
в обычных условиях |
Вызывают
увеличение регионарного сосудистого сопротивления в почечном бассейне и
усугубляют ОПН |
|
|
Нитропруссид Na |
Ионизированный
в обычных условиях |
Содержит
в своем составе цианид, который превращается в тиоцианат, выводимый почками.
Последний обладает выраженным нейротоксическим эффектом, таким образом, при
ОПН происходит накопление тиоцианата. Применение при ОПН, в силу
вышеуказанной причины, нежелательно |
|
|
Сердечные (дигоксин) |
|
Выводятся
почками, в связи с чем необходимо подобрать дозу насыщения до операции |
ОБЩИЕ ПРИНЦИПЫ АНЕСТЕЗИОЛОГИЧЕСКОГО
ОБЕСПЕЧЕНИЯ БОЛЬНЫХ С ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ
Предоперационная
подготовка
Необходимо установить
этиологию почечной недостаточности и провести этиопатогенетическое лечение.
После достижения максимально возможного уровня компенсации необходимо
определить степень повреждения функции почек, так как это крайне важно для
выбора тактики анестезиологического обеспечения.
Анамнез, данные
инструментальных и лабораторных исследований
При сборе анамнеза и осмотре
необходимо обратить внимание:
— на наличие дизурии,
полиурии, отеков;
— на получаемую терапию
(диуретики, гипотензивные препараты, препараты К+, сердечные
гликозиды и медикаменты, обладающие нефротоксичньш действием);
— находится (находился) ли
пациент на диализе, продолжительность, кратность, переносимость и т.д.;
— в общем анализе мочи на
рН, протеинурию, содержание азотистых шлаков;
— на удельный вес мочи. Если
хотя бы в одном анализе получен удельный вес более 1020, считается, что
концентрационная функция почек не страдает. Следует иметь в виду, что
осмотические диуретики и рентгенконтраст повышают осмолярность и удельный вес
мочи, что может привести к неправильным заключениям;
— на электролиты мочи,
осмолярность и креатинин, помогающие определить характер и степень повреждения
функции почек (см. табл. 5.1),
— азот мочевины крови (BUN) —
важный показатель функции почек. Изменяется в зависимости от волемического
статуса, сердечного выброса, диеты;
— на креатинин плазмы. В
норме составляет 6—12 мг/л. Весьма важный показатель. Принято считать, что
увеличение уровня креатинина в 2 раза свидетельствует о 50%-ной потере
фильтрационной способности почек;
— на клиренс креатинина (Кк).
В норме составляет 80— 120 мл/мин. Считается наиболее точным тестом, отражающим
компенсаторные резервы почек. Рассчитывается по формуле
(140-возраст) • вес (кг)
Кк = ——————————————— .
72 •
креатинин плазмы
Необходимо умножить на
коэффициент 0,85 у женщин;
— содержание электролитов в
плазме крови достаточно долго остается на нормальных значениях, вплоть до
развития декомпенсации. Следует особо тщательно оценить риск немедленной
операции, если уровень Na+ меньше 131 или больше 150 мэкв/л, К+
соответственно — 2,5 и 5,9 мэкв/л;
— исследование Hb может
выявить анемию;
— общий белок, как правило,
снижен при ОПН.
Пациенты с
повышенным риском интраоперационного развития ОПН
— пожилые пациенты, так как
резервы компенсации с возрастом уменьшаются;
— пациенты с почечной
патологией;
— пациентам с Кк >
50 мл/мин не требуются специальная подготовка и особые анестезиологические
мероприятия;
— пациентам с Кк 50—20
мл/мин требуются специфическая предоперационная подготовка и поддержание
адекватного почечного кровотока во время операции;
— пациенты с Кк <
20мл/мин, как правило, находятся на диализе;
— пациенты с патологией
сердца или больные с предстоящей операцией на сердце;
— пациенты, которым
предстоит ангиографическое исследование, и больные с патологией магистральных
сосудов;
— пациенты с тяжелой травмой
и ожогами;
— пациенты с гиповолемией
(сепсис, шок, гипертермия);
— пациенты со
злокачественной гипертермией.
Премедикация
Должна проводиться с учетом
степени нарушения выделительной функции почек и описанных выше особенностей
действия лекарственных препаратов.
Анестезиологическое
пособие
В равной степени возможна как
регионарная, так и общая анестезия, но в первом случае внимательно следят за
состоянием свертывающей системы крови. При выборе общей анестезии целесообразно
использовать изофлюран и закись азота. Целесообразно предпочесть
интубационный наркоз через трубку с манжетой, гарантированно перекрывающей
просвет трахеи (большой риск аспирации и регургитации). Наркотики применяют
особенно осторожно. Мышечные релаксанты вводят по мере необходимости,
желательно под контролем уровня нервно-мышечной проводимости (релаксограф).
Дозы препаратов для вводного
наркоза, как правило, ниже обычных.
Инфузионная
терапия
При коротких, малоинвазивных
вмешательствах используют небольшие объемы изотонического раствора хлорида
натрия.
При длительных вмешательствах
целесообразно проводить инфузионную терапию под контролем давления в легочной
артерии или ЦВД.
АЛГОРИТМ ДЕЙСТВИЯ АНЕСТЕЗИОЛОГА ПРИ
НАРУШЕНИИ МОЧЕОТДЕЛЕНИЯ
В норме тем мочеотделения
составляет 0,5—1 мл/(кг/ч).
Олигурия. Снижение темпа
диуреза
ниже 25 мл/ч.
Лечение
— проверка правильности
положения мочевого катетера и его проходимости;
— коррекция гипотонии для
нормализации почечного кровотока;
— коррекция гиповолемии;
— увеличение почечного
кровотока с помощью инфузии допамина (со скоростью 2—4 мкг/кг/мин);
введения маннитола — 12,5—25
г в/в; введения лазикса — 20—40 мг в/в.
Анурия. Редкое осложнение
интраоперационного периода. Необходимо исключить механические причины, препятствующие
оттоку мочи.
Гиперпродукция мочи. Наблюдается при повышенной
водной нагрузке, однако необходимо исключить также гипергликемию, действие
диуретиков. Не требует специфической терапии, необходимы коррекция КОС и
предупреждение гиповолемии.
Глава 6
АНЕСТЕЗИОЛОГИЧЕСКОЕ
ОБОРУДОВАНИЕ
В.В. Субботин
При всей вариабельности задач, стоящих перед анестезиологом в зависимости от характера хирургического вмешательства, физического статуса больного, избранной техники анестезии, любая операционная как минимум должна быть оснащена:
— наркозно-дыхательным аппаратом,
— монитором,
— дефибриллятором,
— набором для пункции и катетеризации:
— периферических вен,
— центральных вен,
— артерий,
— эпидурального пространства
и спинномозгового канала,
— набором для интубации трахеи,
— наркозными масками различных размеров,
— ларингеальными масками различных размеров (желательно),
— минимальным набором лекарственных препаратов,
— отсосом для эвакуации слизи и содержимого ротовой
полости,
— набором высокой готовности для коникотомии или трахеостомии (желательно).
НАРКОЗНО-ДЫХАТЕЛЬНЫЙ АППАРАТ
Основные задачи
наркозно-дыхательного аппарата:
— протезировать функцию
внешнего дыхания, иными словами, проводить искусственную вентиляцию легких;
— точно дозировать и
подавать пациенту газонаркотическую смесь;
— удалять избыток углекислого
газа и отработанную газонаркотическую смесь.
В рамках краткого руководства
трудно описать особенности всех существующих моделей наркозно-дыхательных
аппаратов, поэтому далее будут изложены лишь общие принципы работы с
«усредненным» наркозно-дыхательным аппаратом.
Любой наркозный аппарат
состоит:
— из системы доставки
медицинских газов, камеры смешивания и перераспределения. Современный
наркозно-дыхательный аппарат, как правило, работает с тремя медицинскими газами:
кислородом, сжатым воздухом и закисью азота. Система медицинской безопасности
(во избежание неправильного соединения) требует, чтобы каждый элемент
соединения (коннекторы, шланги) были маркированы соответствующим цветом:
кислород — голубым (Международный стандарт — зеленый), закись азота —
серым (Международный стандарт — голубой), сжатый воздух —
Международный стандарт — желтым. Кроме того, коннекторы сделаны таким
образом, что невозможно соединить магистраль закиси азота с входом для
кислорода наркозного аппарата, и наоборот. Это особенно важно помнить при
закупке импортного наркозно-дыхательного аппарата, неадаптированного для
применения в России. Данный цветовой код повторяется и далее — на ручках и
шкалах ротаметров и т.д.
При централизованном
снабжении сжатым воздухом целесообразно установить на наркозно-дыхательный
аппарат дополнительные масляные фильтры.
После понижающего редуктора
медицинские газы попадают в наркозно-дыхательный аппарат через систему флоуметров
или ротаметров, с помощью которых можно регулировать поток «свежих»
медицинских газов в контур пациента. Следует помнить, что:
— ошибка показаний ротаметра
составляет 5—7%, для электронных ротаметров (EAS 9010, Engstrom,
Швеция)
— 3%. Эта ошибка, которой
можно пренебречь при работе с обычными потоками, становится ощутимой при
проведении Low Flow Anaesthesia;
— конструкцией большинства
аппаратов предусмотрено автоматическое отключение подачи закиси азота при установке
«гипоксической» (концентрация кислорода на вдохе менее 30%) смеси;
— конструкция практически
всех аппаратов предусматривает наличие кнопки «экстренной подачи кислорода в
дыхательный контур», нажатие на которую позволяет быстро заменить содержимое
дыхательного мешка на чистьш кислород;
— из собственно
вентилятора с контуром пациента, или механической системы, позволяющей
проводить ИВЛ. В настоящее время большинство наркозно-дыхательных
аппаратов является объемными респираторами, т.е. переключение с фазы вдоха на
фазу выдоха происходит после подачи больному соответствующего (установленного
врачом) дыхательного объема. В противоположность этому некоторые
прессциклические вентиляторы (Siemens Servo 900
С) переключают дыхательный цикл после достижения заранее заданного давления в
дыхательных путях. Как правило, все объемные респираторы позволяют
программировать минутный объем дыхания (МОД) и частоту дыхания (ЧД) (объем
дыхания (ОД) — как производное названные двух). Более совершенные аппараты
позволяют менять соотношение вдох/выдох вплоть до инверсного, создавать
«плато» и регулировать его продолжительность в фазу вдоха, изменять форму
кривой потока на вдохе. Ряд аппаратов оснащен клапанами РЕЕР/СРАР (Positive End Experience Pressure —
положительное давление в конце выдоха)/(Соп1тиои$ Positive Airway Pressure — постоянное положительное давление в дыхательных
путях) и некоторыми вспомогательными режимами вентиляции. Эти
усовершенствования, мало влияя на собственно «наркоз», позволяют проводить
респираторную терапию во время анестезии (что очень важно у лиц со скомпрометированной
системой дыхания или кровообращения) и более плавно и комфортно переводить
пациентов с ИВЛ на самостоятельное дыхание.
Помимо механической
вентиляции наркозно-дыхательный аппарат должен работать в режиме спонтанного
дыхания с целью:
— проведения наркоза при
сохраненном спонтанном дыхании;
— проведения «ручной»
вентиляции в случае поломки аппарата или отключения электроэнергии (на современных
аппаратах предусмотрено наличие резервных аккумуляторов, позволяющих некоторое
время работать от автономного источника питания).
Для клинициста в настоящее
время важно знать два основных типа дыхательных контуров: полуоткрытый (nonrebreathing) и полузакрытый (rebreathing). В первом случае в фазу
вдоха пациент получает газонаркотическую смесь из аппарата, выдох происходит в
атмосферу. Во втором случае (полузакрытый контур) и вдох, и выдох происходят с
помощью аппарата, избыток отработанных газов удаляется через эвакуаторную
систему.
Сомнительные преимущества
первого варианта — простота и отсутствие необходимости в постоянном газовом
мониторинге. Основные преимущества полузакрытого контура — экономия
дорогостоящего ингаляционного анестетика и сброс отработанных газов, минуя
операционную. Правда, при выборе полузакрытого контура необходим адсорбер
углекислоты и мониторинг ряда показателей: содержания СО2 в конце
выдоха и в контуре пациента, содержание кислорода и закиси азота в контуре.
Непременным атрибутом
полузакрытого контура является адсорбер, заполненный натронной известью,
которая в результате химического взаимодействия с углекислотой образует
углекислый кальций. Реакция протекает с образованием тепла, и поэтому на ощупь
легко определить время работы адсорбера. Импортная натронная известь содержит
индикатор, который меняет цвет по мере прекращения поглощения углекислоты. Еще
одним способом контроля качества адсорбента является мониторинг FiCO2.
Обязательным
компонентом системы являются одноходовые клапаны вдоха и выдоха, препятствующие
попаданию выдыхаемой смеси в легкие пациента, минуя адсорбер;
— из испарителя
(испарителей) — устройства для точного дозирования ингаляционных
анестетиков, в современных вариантах — галотан, энфлюран, изофлюран, десфлюран
и севофлюран. В большинстве испарителей используется свойство парообразующих
анестетиков к постоянству давления газа при постоянной температуре. Захват
анестетика происходит малой порцией медицинских газов, проходящих через
испаритель, тогда как основной поток проходит, минуя его (испаритель находится
«вне контура»). Таким образом, очевидно, что чем больше поток медицинских
газов, тем больше захват анестетика и тем больше его концентрация на вдохе.
Современные испарители
термокомпенсированы и тщательно откалиброваны, что, с одной стороны, позволяет
быть уверенным в дозе препарата, с другой — не позволяет использовать один и
тот же испаритель для разных анестетиков;
— из системы эвакуации
отработанных газов. Обязательна при работе по
полузакрытому контуру и в разных модификациях (активная, пассивная)
предусматривает сброс отработанных газов в атмосферу, минуя операционную.
Необходимо учитывать, что
часто практикуемое в нашей стране удлинение шланга для сброса отработанных
газов неэффективно в силу физических законов (сопротивление в удлиненной
трубке гораздо выше необходимого и аппарат теряет герметичность). Результат —
сброс все равно происходит в операционную. В этой связи необходимо закупать
системы для эвакуации отработанных газов в центральный вакуум или пользоваться
химическими (физическими) сорбентами — фильтрами;
— из монитора,
позволяющего контролировать основные параметры дыхания. Речь о мониторинге
дыхания как составной части мониторинга безопасности пойдет ниже, здесь лишь
стоит указать, что современный наркозно-дыхательньш аппарат должен
мониторировать давление в дыхательных путях, ДО (дыхательный объем), МОД
(минутный объем дыхания), ЧД (частота дыхания) и обладать точной индикацией
концентрации подаваемых медицинских газов (ротаметры О2,
N2O, воздух) и их содержания в контуре пациента,
измерением содержания ингаляционного анестетика (в контуре пациента и в
подаваемой свежей газонаркотической смеси), капнографом. Современные
наркозно-дыхательные аппараты оснащены системой «тревоги», информирующей врача
о разгерметизации контура, технической неисправности аппарата, превышении
допустимых границ давления в фазу вдоха и т.д.
ДЕФИБРИЛЛЯТОР
Современный дефибриллятор,
как правило, сочетает в себе три функции:
— собственно дефибриллятора с
возможностью проведения разряда наружными «ложками», электродом, расположенным
непосредственно на миокарде и с наружных клеящихся пластин;
— кардиоскопа, при этом
сигнал ЭКГ снимается как с «ложек» дефибриллятора, так и с клеящихся пластин;
— кардиостимулятора
(пейсмекера). При этом ритм может быть навязан опять-таки с «ложек»
дефибриллятора, клеящихся наружных пластин и эндокардиального электрода.
НАБОР
ДЛЯ ПУНКЦИИ И КАТЕТЕРИЗАЦИИ
— периферических вен. Различные фирмы выпускают широкий спектр в/в канюль различного
диаметра, оснащенных портом для капельного введения растворов и портом для
болюсного введения медицинских препаратов;
— центральных вен.
Существуют наборы высокой готовности для катетеризации внутренней яремной вены
или подключичной вены, как с использованием техники Сельдингера, так и катетеры
«на игле» (Abbott, США);
— артерий;
— эпидурального пространства
и спинномозгового канала. В настоящее время имеются также наборы для параллельной
установки катетеров в эпидуральное пространство и спинномозговой канал для
проведения спиноэпидуральной анестезии.
НАБОР ДЛЯ ОБЕСПЕЧЕНИЯ ПРОХОДИМОСТИ
ДЫХАТЕЛЬНЫХ ПУТЕЙ И ИНТУБАЦИИ ТРАХЕИ
— ларингоскоп с набором
клинков соответствующих размеров (тип Макинтош № 1 — для новорожденных, № 2 —
для детей и женщин, № 3 — универсальный клинок для взрослых, № 4 — для людей с
длинной шеей). Следует иметь в виду, что для трудной интубации фирмой Penlon
(Великобритания) разработаны ларингоскопы с различным углом наклона клинка и
клинок с изменяемой геометрией. Имеется возможность интубации с помощью
фибробронхоскопа (при этом размер интубационной трубки должен быть № 7 и
более);
— воздуховоды (для взрослых
— размеры 3—5);
— ларингеальные маски
соответствующих размеров;
— интубационные трубки
(размеры 7—8 для женщин и 8—9 для мужчин). Современные интубационные трубки
оснащены раздуваемой манжетой, препятствующей поступлению содержимого из
ротовой полости в трахею. Фирма Маlincrodt
(Великобритания) разработала и выпускает ингубационные трубки с манжетой низкого
давления, которая не нарушает микроциркуляции в стенке трахеи и не вызывает
образования пролежней;
— гибкий стилет для
проведения интубационной трубки.
МИНИМАЛЬНЫЙ НАБОР ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ ВКЛЮЧАЕТ:
Средства для поддержания
анестезии:
— гипнотик (бриетал,
гексенал, пропофол, ...);
— наркотический аналгетик
(фентанил, морфин, промедол, альфентанил, ремифентанил, ...);
— мышечные релаксанты:
деполяризующие (листенон, дитилин, миорелаксин) и антидеполяризующие (мивакрон,
тракриум, векурониум, ардуан, ...);
— парообразующие анестетики
(галотан, энфлюран, изофлюран, севофлюран, десфлюран).
Каждый препарат набирается и
вводится отдельным маркированным шприцем.
Средства экстренной помощи:
— адреномиметики (адреналин,
допамин, добутамин, ...);
— ваголитики (атропин,
метацин, ...);
— глюкокортикоиды
(преднизолон, дексазон, целестон, ...);
— антиаритмические препараты
(лидокаин, новокаинамид, верапамил, ...);
— гипотензивные препараты
(пропранолол, эсмолол, нитропруссид, нитроглицерин, блокаторы кальциевых
каналов, ...).
Препараты, использование
которых возможно во время наркоза:
антибиотики, мочегонные препараты и др.
Инфузионные растворы:
— изотонический раствор
хлориданатрия;
— 1%- и 3%-ный растворы
хлорида калия;
— раствор Рингера, раствор
глюкозы;
— 4%-ный раствор бикарбоната
натрия;
— трисомин,
...;
— современные плазмозамещающие
растворы [полиглюкин, растворы на основе гидроксиэтилкрахмалов (HAES, Fresenius,
Германия)].
ПОДГОТОВКА
ОПЕРАЦИОННОЙ К РАБОТЕ
Проводится медицинской сестрой-анестезисткой, контролируется — врачом.
Проверяется наличие
медицинских препаратов, инструментария и исправность медицинской техники:
— исправность и работа
ларингоскопа, достаточность заряда аккумулятора;
— наличие маски,
воздуховодов и интубационной трубки соответствующего размера;
— наличие давления
медицинских газов в системе;
— проводится контрольное
включение наркозно-дыхательного аппарата. Современные наркозно-дыхательные аппараты
после включения автоматически проводят внутреннее тестирование (Cato, Dreger,
Германия) или у них имеется клавиша включения внутреннего теста (EAS
9010, Engstrom, Швеция). После завершения процесса на дисплее
появляется надпись о готовности аппарата к работе.
Если подобная система отсутствует, включают в рабочий режим аппарат с надетым мешком на конце Y-образной трубки и проверяют правильность работы аппарата «на глаз»:
— правильность сборки
дыхательного контура, отсутствие окклюзии или повреждений;
— наличие адсорбера и
правильность его заполнения свежей натронной известью;
— герметичность аппарата.
Закройте конец Y-образной трубки. Установите все ротаметры на «О» или «минимум»,
закройте клапан сброса отработанных газов. Нажмите клавишу экстренной подачи
кислорода и доведите давление в контуре до 30 см Н2О. Давление должно
держаться на заданной цифре не менее 10 с после прекращения подачи кислорода;
— работу системы эвакуации
отработанных газов. Приведите в действие систему при закрытом клапане сброса
отработанных газов. Доведите давление в контуре до 50 см Н2О при закрытом конце
Y-образной трубки. Откройте клапан сброса и убедитесь, что давление в контуре
падает. Полностью откройте клапан сброса и убедитесь, что манометр показывает
«0» как при минимальном
потоке медицинских газов, так и при «рабочем» потоке.
Данная процедура проводится
ежедневно, а не реже чем раз в полгода аппарат осматривает инженер-специалист;
— исправность монитора и
контрольных датчиков. только после
проведения всех перечисленных процедур можно приступать к вводному наркозу.
Глава 7
ПУНКЦИОННАЯ
КАТЕТЕРИЗАЦИЯ ВЕН
В.Л. Виноградрв
ОБЩИЕ ПОЛОЖЕНИЯ
Катетеризация вен
используется для:
— проведения инфузионной и
лекарственной терапии, парентерального питания;
— измерения венозного
давления;
— введения красителя для
измерения минутного выброса сердца методом разведения красителя;
— проведения трансвенозной
электрокардиостимуляции. Различают катетеризацию периферических и центральных
вен, причем при отсутствии специальных показаний предпочтение отдается
периферическим венам, ввиду значительно меньшего риска, связанного с данной
процедурой.
КАТЕТЕРИЗАЦИЯ
ПЕРИФЕРИЧЕСКИХ ВЕН
Показания к катетеризации
периферических вен:
— необходимость в/в введения
лекарственных препаратов;
— проведение
инфузионно-трансфузионной терапии и/или парентерального питания.
Противопоказаний к
катетеризации периферических вен нет. При наличии воспалительных или гнойных процессов
в области предполагаемой пункции производят катетеризацию вен в неизмененной
области.
Возможно использование любой
подкожной вены. Чаще всего применяют катетеризацию вен локтевого сгиба, кистей
рук, стоп. Допускается одновременная катетеризация нескольких подкожных вен. В
асептических условиях производят венепункцию с помощью специальной канюли,
изготовленной из современного синтетического материала (например,
полиуретана), надетой на иглу, которая используется как стилет. После
идентификации и вены катетер продвигается в глубь ее просвета и фиксируется к
коже клеящим материалом (лейкопластырь), игла удаляется. Единственным осложнением катетеризации
периферических вен (помимо образования гематом) является развитие флебита и
тромбофлебита, которые возникают тем чаще, чем продолжительнее срок функционирования
катетера. При развитии осложнений использование вены прекращают, а катетер
удаляют. Целесообразно наложение давящей повязки с мазью на гепариновой
основе. Средний срок использования полиуретанового катетера с антисвертывающим
покрытием при ежедневной смене окружающих салфеток с дезинфицирующим
материалом и промывании раствором гепарина (в разведении 1:100 — 1,0 мл) по
окончании использовании катетера, — 3—7 дней.

Рис. 7.1. Шкала размеров внутривенных
катетеров в различных системах мер
КАТЕТЕРИЗАЦИЯ
ЦЕНТРАЛЬНЫХ ВЕН
Для катетеризации верхней
полой вены используют доступ:
— через внутреннюю яремную
вену;
— через подключичную вену;
— через наружную яремную
вену;
— в чрезвычайно редких
случаях, по специфичным показаниям и специальным катетером, используется
доступ через вены плечевого сгиба или другие, подходящие по размеру, периферические
вены.
Для катетеризации нижней
полой вены используют доступ через бедренную вену.
Внутренняя яремная вена
более подвижна (по сравнению с подключичной), и ее пункция технически более
сложна. Однако данный метод следует считать более предпочтительным ввиду
значительно меньшего количества осложнений, с ним связанных (ранения легкого и
плевры), табл. 7.1.
Таблица 7.1
|
|
V. basilica |
V. jugularis extema |
V. jugularis intema |
V. subclavia |
V. femoralis |
|
Простота канюляций |
+++++ |
+++ |
+ |
++++ |
+++ |
|
Длительное использование |
+ |
++ |
+++ |
++++ |
+++++ |
|
Осложнения (связанные с
техникой постановки) |
+++++ |
+++ |
++++ |
+ |
++ |
Примечание. Обозначения от
++++ — отлично, до + — плохо.
Показания к катетеризации
центральных вен:
— Измерение центрального
венозного давления (ЦВД) или преднагрузки правого желудочка как показатель
внут-рисосудистого объема жидкости. В норме ЦВД составляет 8—10 мм рт. ст.
— Введение лекарственных
растворов непосредственно в центральную циркуляцию.
— Обеспечение венозного
доступа у пациентов, у которых доступ через периферические вены по тем или иным
причинам невозможен.
— Проведение длительного
парентерального питания.
— Пп. 3—4 из общих показаний
для катетеризации вен. Катетеризация центральных вен противопоказана при:
— воспалительных и иных
повреждениях в месте предполагаемой пункции;
— синдроме верхней полой вены
и болезни Педжета-Шреттера (травматический тромбоз подключичной вены);
— коарктации аорты
(относительное противопоказание). Если существует возможность катетеризации
нескольких периферических вен, от катетеризации центральной вены следует
отказаться.

1 — procesus mastoideus; 2, 7 — vena jugularis intema;
3,6 — m. stemocleidomastoideus pars clavicularis;
4, 5 — m. stemocleidomastoideus pars stemalis;
Рис. 7.2. Катетеризация
внутренней яремной вены
Катетеризация
внутренней яремной вены (рис. 7.2)
1. Голова повернута в
сторону, противоположную пунктируемой вены, шея слегка разогнута (А).
2. Обеспечивают асептические
условия на участке кожи, границами которого являются ключица, нижняя челюсть и
средняя линия шеи (латеральная порция грудино-ключично-сосцевидной мышцы).
3. Находят точку,
расположенную на середине расстояния между сосцевидным отростком височной кости
и местом прикрепления грудинной порции грудино-ключично-сосцевидной мышцы.
4. Внутренняя яремная вена
может быть пунктирована из данной точки
— медиальнее мьшщы или
— латеральное ее
(точки) — в верхушке треугольника, образованного двумя головками
грудино-ключично-сосцевидной мышцы (В).
5. Больному придается положение
Тределенбурга (желательно, но не обязательно).
6. Пальпаторно определяется
сонная артерия и производится местное обезболивание 2%-ным раствором
лидокаина.
7. Основная игла для пункции
внутренней яремной вены проводится латеральнее артерии по ее ходу под углом 30°
к коже с постоянной аспирацией до идентификации вены (обычно на глубину 2—5
см). Венозная кровь должна поступать в шприц легко, без видимых
усилий (С).
8. Шприц отсоединяется и
через просвет иглы проводится проводник на 4—5 см за конец иглы (метод
Сельдингера). Проводник должен свободно «проскользнуть» в просвет вены.
Иглу извлекают по проводнику (D).
9. По проводнику проводят
основной катетер (при необходимости предварительно используя дилататор — более
жесткий катетер с остроконечным концом; или интродюсер — для проведения
многопросветного катетера) (Е). Проводник удаляют, повторно аспирируют
кровь (контроль положения катетера), катетер фиксируют к коже лигатурами и
промывают слабо гепаринизированным раствором.
10. Возможна техника
катетеризации внутренней яремной вены с использованием катетера, надетого на
стилет. В данном случае после идентификации вены катетер проводят в глубь ее
просвета, а иглу-стилет удаляют.
11. Современные методы
позволяют проводить катетеризацию центральных вен под визуальным контролем с
помощью ультразвука.
12. При возникновении
сомнений в местоположении катетера проводится ультразвуковое или
рентгеноконтрастное исследование.
13. Уход за катетером:
— ежедневная смена стерильных
салфеток с обработкой кожи в месте стояния катетера;
— ежедневное промывание
раствором гепарина после окончания инфузионно-трансфузионной терапии.
14. Недопустимо промывать
тромбированный катетер или стремиться протолкнуть тромб внутрь стилетом или
проводником. При подозрении на тромбирование катетера последний удаляют.
15. Нежелательна повторная
пункция по месту стояния «старого» катетера, рекомендуется использовать
контрлатеральную сторону.
16. В обычных условиях
попытку катетеризации проводят с правой стороны (отсутствует риск повреждения
грудного лимфатического протока). При наличии травмы в области груди,
одностороннего воспалительного или иного патологического процесса в легких для
катетеризации используют вену на стороне поражения.
Катетеризация
подключичной вены
Для катетеризации
подключичной вены используются как над-, так и подключичные доступы из
нескольких точек (рис. 7.3).

Рис.7.3. Катетеризация подключичной
вены (А.А. Бунятян, 1984):
1 — точка Вильсона; 2 — точка
Абаниака; 3 — точка Джилеса;
4 — точка Иоффе; 5 — точка
Килличана; б — ключица;
7 — подключичная вена; 8 —
первое ребро;
9 —
грудино-ключично-сосцевидные мышцы

Подключичные артерия и вена
Рис. 7.4. Направлении иглы
при катетеризации подключичной вены из точки Абаниака
Положение больного
соответствует описанному для катетеризации внутренней яремной вены. Чаще всего
для пункции используют точку Абаниака, расположенную под ключицей на границе ее
внутренней и средней трети. Иглу проводят между первым ребром и ключицей под
углом 45° к последней (в направлении к верхнему краю грудино-ключичного
сочленения). Игла должна скользить строго по внутренней поверхности ключицы,
чтобы избежать пневмоторакса (рис. 7.4).
После идентификации вены
катетер устанавливают согласно описанию в предыдущем разделе.
Осложнения
катетеризации внутренней яремной и подключичной вен
— аритмии. Иногда при проведении
проводника или катетера возникают нарушения ритма сердца в виде политопных
экстрасистол. Чаще всего они проходят самостоятельно, в редких случаях требуют
медикаментозного лечения (лидокаин 2% раствор — 2—4 мл);
— пункция подключичной или
сонной артерии. В этой связи гипокоагуляционный синдром может быть относительным
противопоказанием к катетеризации подключичной вены из-за невозможности внешней
компрессии соответствующей артерии;
— пневмоторакс (реже при катетеризации
внутренней яремной вены);
— гидроторакс (реже при катетеризации
внутренней яремной вены);
— инфекция и воздушная
эмболия.
Катетеризация
бедренной вены
В настоящее время крайне
редко используется в практике анестезиологии-реаниматологии и только при
невозможности катетеризации внутренней яремной или подключичной вены.
Катетеризацию бедренной вены
проводят из точки, расположенной медиальное бедренной артерии ниже пупартовой
связки, по правилам и в положении больного, соответствующим изложенным для
катетеризации яремной вены.
Катетеризация центральных вен
должна производиться грамотным и опытным врачом-анестезиологом-реаниматологом,
владеющим техникой указанной процедуры и готовым к возможным осложнениям и
борьбе с ними.
Рекомендуемая литература:
Бунятян А.А.,
Рябов Г.А., Маневич А.3. Анестезиология и реаниматология.—М.: Медицина,
1984.—512 с.
Davison J.K., Eckhardt III W.F., Perese D.A. Clinical Anesthesia
Procedures of the Massachusetts General Hospital, 4-th Edition.—1993.— 711 p.
Глава 8
ОБЕСПЕЧЕНИЕ
ПРОХОДИМОСТИ ДЫХАТЕЛЬНЫХ ПУТЕЙ
А.В. Ситников
АНАТОМИЯ (НЕКОТОРЫЕ ОСОБЕННОСТИ)
Верхние дыхательные пути —
это область ротоглотки, находящаяся над голосовыми связками. Она состоит из
носовых ходов, ротовой полости, глотки.
Носовые ходы образованы
следующими анатомическими структурами:
— носовой перегородкой;
— носовыми раковинами;
— аденоидами.
Глотка имеет в своем составе
миндалины, язычок и надгортанник.
Нижние дыхательные пути —
все анатомические структуры, находящиеся ниже голосовых связок (самый узкий
участок дыхательных путей у взрослых, ограничивающий размер эндотрахеальной
трубки). Гортань располагается на уровне от IV до VI шейного позвонка,
представляет собой сложное образование, состоящее из хрящей, связок и мышц.
Гортань образуют 9 хрящей:
— непарные: щитовидный,
перстневидный и надгортанник;
— парные: черпаловидные,
рожковидные и клиновидные.
Перстневидный хрящ. Единственное целостное
хрящевое кольцо в системе дыхания. Расположен под щитовидным хрящом. Это самый
узкий участок дыхательных путей у детей.
Крикотиреоидная мембрана. Соединяет щитовидный и
перстневидный хрящи. Ее размер у взрослых 0,9—3,0 см. Достаточно тонкая и не
содержит крупных кровеносных сосудов по срединной линии.
Трахея. Фиброзно-мышечная трубка,
около 10—12 см длиной и 20 мм в диаметре (у взрослых). Остовом трахеи являются
20 дугообразных хрящей. Трахея входит в грудную полость через верхнее
средостение и разделяется на главные бронхи на уровне нижнего края IV грудного
позвонка (уровень угла грудины).
Карина (киль трахеи). Участок, где трахея делится
на правый и левый главные бронхи. Правый, длиной около 2—5 см, отходит от
трахеи под углом 25°; левый, около 5 см, — под углом 45°.
ФУНКЦИИ
— Защита дыхательных путей.
— Дыхание.
— Голосообразование.
ИННЕРВАЦИЯ
Сенсорная.
— Глоссофарингеальный нерв
(IX пара черепно-мозговых нервов) иннервирует заднюю треть язьпса и ротоглотку
от границы носоглотки до перехода в пищевод, включая мягкое нёбо, надгортанник
и зев.
— Передний гортанный нерв
(ветвь блуждающего нерва) иннервирует слизистую от надгортанника до голосовых
связок, включая последние.
— Возвратный нерв (ветвь
блуждающего нерва) иннервирует слизистую ниже голосовых связок до трахеи.
Моторная.
— Наружная ветвь переднего
гортанного нерва иннервирует перстнещитовидную мышцу.
— Возвратный нерв
иннервирует все мышцы гортани, кроме перстнещитовидной.
ОЦЕНКА
СОСТОЯНИЯ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Анамнез
Необходимо обращать
пристальное внимание на заболевания, которые могут оказать влияние на
состояние и проходимость дыхательных путей.
— Артриты могут в
значительной степени снижать подвижность шейного отдела позвоночника. Для
ревматоидного артрита характерна нестабильность шейного отдела позвоночника. В
этих условиях подвывих сочленения между I и II шейными позвонками может
привести к разобщению атланто-зубовидного сочленения и проникновению
зубовидного отростка в foramen magnum
со сдавлением спинного мозга. Синовиит теменно-нижнечелюстного сустава может
значительно ограничивать движение нижней челюсти. При этом в воспалительный
процесс часто вовлекаются черпаловидные хрящи.
— Инфекционно-воспалительные
процессы дна полости рта, слюнных желез, миндалин, а также глоточный абсцесс,
вызывая боль, отек или тризм, могут ограничивать объем открывания рта.
— Опухоли могут перекрывать
дыхательные пути, а также вызывать сдавление или смещение трахеи.
— У пациентов, страдающих
ожирением, необходимо выяснить наличие «храпа» («сонного апноэ»), причиной
которого может быть гипертрофия миндалин и аденоидов.
— Травма. Необходимо
выяснить характер травмы и иметь представление о ее механизме в связи с
возможными повреждением шейного отдела позвоночника, переломом основания
черепа или внутричерепной патологией.
— Ожоги.
— Трисомия по 21 хромосомной
паре (синдром Дауна). Пациенты с данной патологией могут страдать
нестабильностью атлантоаксиального сочленения и макроглоссией.
— Склеродермия приводит к
уменьшению подвижности нижней челюсти и сужению ротового отверстия за счет
снижения эластичности кожи.
— Акромегалия. Избыток
гормона роста вызывает гипертрофию нижней челюсти, языка и надгортанника.
Раскрытие голосовой щели может быть ограничено за счет гипертрофии голосовых
связок.
— Нанизм (карликовость). При
данной патологии встречается нестабильность атлантоаксиального сочленения, а
также возможны затруднения при обеспечении проходимости дыхательных путей
из-за гипоплазии нижней челюсти.
— Врожденные аномалии. При
целом ряде синдромов, связанных с врожденными аномалиями, могут возникать
трудности в обеспечении проходимости дыхательных путей. В особенности
пациенты с патологией лицевого черепа.
При наличии документов о
предыдущих вмешательствах необходимо обращать внимание на факты имевших место
осложнений при интубации и вентиляции (возможность масочной вентиляции,
количество попыток интубации, тип клинка ларингоскопа, использование проводника
и т.д.).
Следует выделять специфические
симптомы, связанные с нарушением проходимости дыхательных путей: дисфония,
стридорозное дыхание, дисфагия, одышка, позиционная обтурация.
Предыдушие хирургические
вмешательства и лучевая терапия в области головы или шеи могут осложнять последующие
анестезиологические манипуляции.
Общий
осмотр
Явные, специфические
признаки, указывающие на возможность нарушения проходимости дыхательных путей:
— Невозможность отрыть рот.
— Уменьшение подвижности
шейного отдела позвоночника.
— Срезанный подбородок или
чрезмерно маленыхая верхняя челюсть.
— Выступающие резцы.
— Короткая, мощная шея.
— Патологическое ожирение.
Оценка повреждений в
области:
Лица, шеи или грудной клетки
с точки зрения их возможного влияния на проходимость дыхательных путей.
Общие признаки острой
патологии дыхательных путей:
Возбуждение, страх,
значительные изменения частоты дыхания и показателей спирометрии, тахикардия.
Осмотр головы и шеи
— Нос. Проходимость носовых
ходов и возможное искривление носовой перегородки проверяются путем попеременного
закрытия каждой ноздри с просьбой больному подышать и сказать, в каком случае
дыхание было более свободным. Данная процедура особенно важна при необходимости
назотрахеальной интубации.
— Рот. Больные должны
открывать рот как минимум на ширину трех пальцев.
— Зубы. Уменьшенное
количество зубов увеличивает риск повреждения оставшихся при выполнении
анестезиологических манипуляций. Перед операцией необходимо выяснить наличие
шатающихся зубов, которые либо должны быть удалены, либо защищены специальным
пластиком.
— Язык. Макроглоссия
рассматривается как врожденная аномалия.
— Шея. Расстояние от нижнего
края нижней челюсти до щитовидного хряща меньше ширины 3—4 пальцев указывает
на возможную трудность в визуализации трахеи.
— Подвижность шейного отдела
позвоночника. Необходимо убедиться, что больной может коснуться подбородком
грудной клетки и разогнуть шею назад.
— Наличие рубцов или
трахеостомы указывают на возможность подсвязочного стеноза.
Классификация дыхательных
путей
Классификация по Mallampati
основана на том положении, что если корень языка непропорционально большой и
заслоняет собой вход в гортань, то при проведении ларингоскопии весьма
вероятны трудности с выяснением расположения последней. Оценку выполняют в
сидячем положении пациента, голова по центру, рот максимально открыт, язык
полностью высунут.
Класс I. Полностью видны
дужки, мягкое нёбо и язычок.
Класс II. Видны дужки и
мягкое нёбо, а язычок прикрыт корнем языка.
Класс III.
Визуализируется только мягкое нёбо. У больных с данным классом дыхательных
путей можно предположить сложности при выполнении интубации.
Инструментальное
обследование
У большинства больных
тщательный опрос и осмотр вполне достаточны для оценки состояния дыхательных
путей. Однако в случае необходимости они могут быть дополнены.
Ларингоскопия (непрямая,
прямая, фиброоптическая). Дает информацию о состоянии нижних отделов глотки, голосовой щели,
функции голосовых связок. Может выполняться у больных в сознании под местной
или проводниковой анестезией.
Радиографическое
исследование грудной клетки. Позволяет обнаружить отклонения или сужения
трахеи.
Томографическое исследование
трахеи.
Рентгенологическое
исследование шейного отдела позвоночника. Является обязательным при травмах, особенно
при повреждениях выше уровня ключицы.
Компьютерная томография. Может дать дополнительную
информацию при обтурации дыхательных путей инородными телами.
Функциональные легочные тесты
и кривые поток/объем. Позволяют определить степень и уровень обструктивных нарушений.
Показатели газового состава
артериальной крови. Помогают выявить больных с хронической гипоксией или гиперкапнией.
ОСНОВНЫЕ
ВИДЫ ВЕНТИЛЯЦИИ
Масочная
вентиляция
Показания
— Проведение ингаляционной
анестезии при коротких операциях у больных без риска регургитации.
— Преоксигенация
(денитрогенизация) у больных перед интубацией трахеи.
— ИВЛ в комплексе
реанимационных мероприятий.
Техника
— Необходимо правильное
расположение лицевой маски и обеспечение проходимости дыхательных путей.
— Маска выбирается такого
размера, чтобы герметично закрывать переносицу, щеки и рот. Предпочтительно
использование прозрачных масок, которые позволяют наблюдать за губами (цвет) и
ртом (секреция, рвота).
— Месторасположение лицевой
маски. Маску принято держать левой рукой, при этом мизинец расположен на углу
нижней челюсти, 3-й и 4-й пальцы держат нижнюю челюсть, а указательный и
большой — маску. Правая рука используется для контроля за мешком. Если больной
крупный, для правильной фиксации маски могут понадобиться обе руки. В этом
случае необходим помощник для контроля за дыхательным мешком. Для плотного и
удобного прилегания маски используют специальные крепления.
— Серьезную проблему
представляют больные без зубов из-за уменьшенного расстояния между челюстями. В
этом случае следует
применять воздуховод. Для уменьшения утечки необходимо плотно прижимать маску,
поэтому часто оказываются заняты обе руки.
— Вентиляция может быть
вспомогательной или принудительной.
— На нарушение проходимости
дыхательных путей указывают стридорозное дыхание, высокий «каркающий» звук,
качелеобразные движения грудной клетки и живота. Дополнительным признаком
может служить отсутствие колебаний мешка пациента.
— Приемы для поддержания
проходимости дыхательных путей:
— переразгибание шеи;
— выдвижение нижней челюсти,
располагая пальцы под ее углами и поднимая ее вверх;
— применение воздуховода
позволяет сохранять проходимость при обтурации крупным языком или мягким
нёбом. Однако при наличии рвотного рефлекса воздуховод не всегда уместен.
Осложнения при использовании воздуховода: рвота, ларингоспазм, травма зубов.
Слишком короткий воздуховод за счет давления на язык может вызвать полную
обтурацию дыхательных путей;
— носовые катетеры применяют
при минимальной обтурации дыхательных путей, а также у пробуждающихся и
седатированных больных с сохраненным рвотным рефлексом. Использование носового
катетера может вызвать кровотечение, поэтому следует избегать их применения у
больных, получающих антикоагулянты.
Осложнения
При масочной вентиляции
высока опасность аспирации, так как дыхательные пути остаются незащищенными,
возможно развитие ларингоспазма. Неудобством считается занятость обеих рук.
Ларингеальная
маска (ЛМ)
Существует четыре размера
ЛМ:
Детские:
1-й — для больных весом
менее 6,5 кг,
2-й — для больных весом от
6,5 до 25 кг. Взрослые:
3-й и 4-й.

Рис. 8.1. Правильное
положение ларингеальной маски
ЛМ заводят в глотку и
продвигают вглубь, пока она не займет свое «анатомическое» положение за
гортанью. При этом голосовая щель остается непрекрытой надгортанником (рис.
8.1). Вентиляцию начинают после раздувания манжетки.
Подтверждением правильности
стояния ЛМ служит легкое сопротивление окружающих гортань тканей и возвратное
движение коннектора ЛМ (на несколько миллиметров) при раздувании манжетки. ЛМ
позволяет осуществлять ИВЛ, поддерживает проходимость дыхательных путей при
невозможности визуализации и интубации трахеи по стандартной технике, а также
может использоваться в качестве проводника для эндотрахеальной трубки (ЭТТ)
(ЭТТ № 6 может проходить через ЛМ № 3 и 4). Случаи недостаточной герметичности
возникают довольно редко. ЛМ не предохраняет от регургитации и аспирации. При
инсталяции ЛМ необходима местная, регионарная или общая анестезия.
Интубация
трахеи
Оротрахеальная интубация
Показания
— Обеспечение проходимости
дыхательных путей для анестезии, продолжительность которой превышает 1 ч, продленной
искусственной вентиляции легких.
— Высокий риск аспирации
желудочного содержимого.
— Невозможность обеспечения
адекватной вентиляции легких при помощи маски.
— Некоторые виды оперативных
вмешательств (операции на голове или шее, кардиоторакальные,
интраабдоменальные и т.д.).
Техника
Обычно интубация трахеи
производится с помощью ларингоскопов. Наиболее часто используются клинки типа
Макинтош или Миллер (модификация клинка типа Магилла).
Тип Макинтош — это клинок,
имеющий определенную кривизну. Конец клинка при интубации трахеи устанавливается
в углубление, образованное основанием языка и фарингеальной поверхностью
надгортанника. Это обеспечивает хороший обзор рото- и гортаноглотки и создает
достаточно большое пространство для продвижения ЭТТ с наименьшей вероятностью
повреждения надгортанника. Существует четыре типоразмера клинка: 1, 2, 3, 4.
Для взрослых наиболее часто применяется 3-й размер клинка Макинтош.
Тип Миллер (Магилл) — это
прямой клинок. Он продвигается при интубации трахеи таким образом, чтобы его
конец оказался под ларингеальной поверхностью надгортанника. В таком положении
надгортанник поднимается кверху, открывая вид на голосовые связки. Миллеровский
клинок приводит к лучшему обзору гортани (голосовых связок), но затрудняет
проведение трубки (за счет уменьшения пространства) в рото- и гортао-глотке.
Существует также четыре типоразмера клинка: 0, 1, 2, 3. Для взрослых наиболее
часто применяются 2-й и 3-й размер клинка Миллер.
Наилучшее положение для
интубации: пациент должен лежать на спине с поднятой на 10 см головой, за счет
подушки или вдвое сложенного одеяла, подложенных под затылок. Это обеспечивает
сгибание нижнешейного отдела позвоночника. При разгибании в атлантозатылочном
сочленении происходит выравнивание осей рта, глотки и гортани (трахеи) таким
образом, что расстояние от губ до гортани становится наименьшим, т.е. они
лежат на одной прямой. Позиция «человека, вдыхающего утренний воздух». Нижняя
челюсть должна быть выведена вперед.
Ларингоскоп держат в левой
руке, ближе к соединению рукоятки с клинком. Положение для интубации обеспечивают
указательным пальцем правой руки. Средним пальцем правой руки, отдавливая
нижнюю челюсть, открывают рот, а также исключают ущемление языка и губ между
клинком ларингоскопа и зубами или деснами. После этого ларингоскоп вводят в
ротовую полость с правого угла рта, оберегая резцы; язык отводят влево. Затем
клинок продвигают по срединной линии до тех пор, пока в поле зрения не появится
надгортанник. Язык и мягкие ткани глотки поднимаются клинком для того, чтобы
увидеть вход в гортань. С этой целью ларингоскоп нужно поднимать строго вверх
за счет силы всей руки, а не за счет кисти, опираясь на передние зубы верхней
челюсти. Последнее может привести к травме верхних резцов или десен (интубация
клинком типа Макинтош).
Размер интубационной трубки
зависит от вида оперативного вмешательства, возраста и антропометрических
данных пациента. Для большинства женщин используется 7,0-мм ЭТТ, для
большинства мужчин — 8,0-мм ЭТТ. ЭТТ держится в правой руке как карандаш,
вводится в ротовую полость с правого угла рта, продвигается через ротовую
полость, а затем через голосовые связки. Если голосовую щель не видно, то
можно использовать ларингеальную поверхность надгортанника, как направляющую
для ингубационной трубки при проведении ее за голосовую щель.
Возможно также использовать
прием, при котором осуществляется внешнее надавливание на перстневидный хрящ
для улучшения обзора голосовой щели (прием Селика).
В случае, когда голосовая
щель плохо видна или вообще не визуализируется, рекомендуется использовать ЭТТ
со вставленным в нее стилетом (проводником). При использовании стилета
(проводника) его необходимо удалить, как только конец интубационной трубки
зашел за голосовые связки. ЭТТ устанавливается таким образом, чтобы
проксимальный край манжетки интубационной трубки находился сразу за голосовыми
связками. Маркировка ЭТТ нанесена по отношению к резцам или губам. Манжетка
раздувается до полной обтурации трахеи.
Правильность постановки
интубационной трубки определяют по концентрации углекислого газа в конце
выдоха (EtCO2) и аускультации легких и желудка. Если дыхательные
шумы выслушиваются только справа или слева, то это означает, что интубационная
трубка продвинута в правый или левый (крайне редко) бронх. В этом случае трубку
необходимо подтянуть назад до тех пор, пока дыхательные шумы будут
прослушиваться с двух сторон одинаково.
Необходима аускультация всех
отделов легких, так как прослушивание только верхушек может привести к
неправильной трактовке шумов: они могут быть проводными из другого легкого или
желудка.
После интубации трахеи ЭТТ
должна быть надежно зафиксирована. Фиксируют или пластырем к щеке (необходимо
два оборота пластыря вокруг трубки), или привязывают трубку к кляпу.
Осложнения
— Повреждение губ, зубов,
языка, слизистой глотки, гортани и трахеи.
— Разрыв трахеи.
— Вывих черпаловидных
хрящей.
— Травма голосовых связок.
Назотрахиальная интубация
Показания
— Операции в полости рта.
— Необходимость продленной
интубации трахеи в послеоперационном периоде (так как такой вид интубации обеспечивает
больший комфорт пациенту и уменьшает возможность перегиба ЭТТ).
— Такая интубация также
уменьшает манипуляции с шейным отделом позвоночника, что очень важно у больных
с нестабильностью данного отдела.
Противопоказания
— Перелом основания черепа,
особенно перелом os. ethmoidalis (решетчатая кость).
— Перелом костей носа,
хронические носовые кровотечения (носовые полипы — относительное
противопоказание для интубации через нос).
Техника
Слизистая носа для анестезии
и вазоконстрикции обрабатывается лидокаин-адреналиновой смесью. Если оба
носовых хода доступны, то для интубации выбирается обычно правый, потому что
скос большинства ЭТТ при прохождении носового хода обращен к носовой
перегородке, что уменьшает вероятность травмирования носовых раковин. Размер
ЭТТ ограничен из-за нижних носовых раковин. Обычно для женщин используются
6,0—6,5 мм ЭТТ, а для мужчин — 7,0—7,5 мм ЭТТ. После прохождения носового хода
и глотки трубка попадает в голосовую щель. При назотрахеальной интубации можно
использовать ларингоскоп и щипцы Магилла для облегчения проведения ЭТТ.
Осложнения
— Те же, что и при оротрахеальной
интубации.
— Носовое кровотечение,
подслизистые разрывы, отрыв миндалин и аденоидов.
— Инфекция гайморовых и
лобных пазух, бактеремия.
Интубация в сознании
Показания
Оротрахеальная или
назотрахеальная интубация показана в следующих случаях:
— ожидаемая трудная
интубация у пациентов с высоким риском аспирации желудочного содержимого;
— сомнения в возможности
вентиляции или интубации после индукции (например, высокая степень ожирения);
— необходимость в проверке
неврологического статуса после интубации или позиционирование для
хирургического вмешательства (например, пациенты с нестабильностью (переломом)
шейного отдела позвоночника).
Техника
Для обеспечения интубации
трахеи в сознании после полоскания 4%-ным раствором лидокаина необходимо
использовать лидокаиновый спрей или распылитель для уменьшения чувствительности
верхних дыхательных путей.
Возможно использовать
проводниковую блокаду следующих нервов:
Верхний ларингеальный нерв. Блокаду выполняют от места
проекции рога подъязычной кости или от щитовидного хряща (рис. 8.2).
Точку на коже отмечают на 1
см медиальное проекции верхнего отростка подъязычной кости. Несколько сдвинув
полоску кожи, иглу размером 25G проводят до соприкосновения
с большим рогом подъязычной кости. Затем иглу поворачивают от кости в
каудальном направлении и проходят через щитоподъязычную мембрану.

Рис. 8.2. Направление иглы
при регионарной анестезии подсвязочного пространства
По второй методике после
местной анестезии кожи иглу вводят к верхнему отростку щитовидного хряща,
проходя через щитоподъязьгчную мембрану. Убедившись, что в шприц поступает
воздух, вводят 2 мл 2%-го раствора лидокаина. Процедуру выполняют с двух
сторон.
Возвратный ларингеальный
нерв может быть заблокирован транстрахеальным доступом. Иглу размером 25G вводят
по срединной линии, через крикотириовдную мембрану в просвет трахеи, что
должно быть подтверждено аспирацией воздуха. Затем вводят 2 мл 2%-го раствора
лидокаина и немедленно удаляют иглу.
После введения анесгетика
пациент начинает кашлять и анестетик распространяется в проксимальном
направлении. Данный вид анестезии не рекомендуется применять у больных с полным желудком
из-за опасности аспирации.
При ларингоскопии в сознании,
кроме проводниковой блокады нервов, описанной выше, можно использовать
седативные препараты, такие, как мидазолам, пропофол, в комбинации с
фентанидом.
Интубация через нос в
сознании может быть выполнена только после адекватной анестезии местными
анестетиками как местно, так и регионарно.
Перед интубацией необходимо
использовать седативные препараты.
Хорошо увлажненную ЭТТ
осторожно продвигают в носоглотку.
Глубокие резонансные
дыхательные шумы обычно свидетельствуют о том, что ЭТТ находится над входом в
трахею. Можно использовать улучшенную позицию для интубации («человек,
вдыхающий утренний воздух»).
Об удачной интубации судят по
отсутствию фонации у пациента, наличию дыхательных шумов при вентиляции и наличию
капнограммы.
Осложнения
Те же, что и для
оротрахеальной интубации.
Интубация
со светящимся проводником
Используется специальный
гибкий волоконно-оптический проводник, по которому ЭТТ может быть вслепую
установлена в трахею.
Интубацию проводят в
затемненной операционной. ЭТТ надевается на проводник, который затем вводится
в ротовую полость, глотку и гортань. Правильность постановки проводника
определяют по светящемуся пятну на передней поверхности шеи. Если пятна нет,
значит, проводник находится в пищеводе. Наличие светового пятна на передней
поверхности шеи свидетельствует о нахождении проводника в трахее. После этого
интубационную трубку сдвигают в трахею, как с обычного проводника.
Интубация
с фибробронхоскопом
Гибкий фиброоптический бронхоскоп состоит из специальных стекловолокон, по которым передаются свет и изображение. Рабочий канал фибробронхоскопа можно использовать для введения местных анестетиков, подачи кислорода или для отсасывания слизи, крови и т.д. из трахеи. Чтобы видимость через бронхоскоп была хорошей, конец брохоскопа перед работой помещают в теплую воду или силикон. Поток кислорода в 10— 15 л/мин позволяет защитить оптику от слизи, секрета и т.д. Стандартное оборудование:
— Мундштук.
— Воздуховод (Ovassapian).
— Местные анестетики.
— Отсос.
— Фибробронхоскоп с
источником света.
Показания
Гибкий фиброоптический
бронхоскоп может быть использован как у пациентов, находящихся в сознании, так
и под наркозом, для диагностики и интубации трахеи. Может быть использован и
для интубации через нос и через рот. Должен использоваться при предполагаемой
трудной интубации в первую очередь, а не как «последняя надежда».
Как предмет выбора
фиброопгическая ишубация должна быть применена у больных с установленным или
предполагаемым повреждением шейного отдела позвоночника, у больных с опухолями
головы и шеи, при ожирении или в случае известной или предполагаемой трудности
при вентиляции и интубации.
Техника
ЭТТ надевается на
бронхоскоп, к рабочему каналу подсоединяется кислород, правой рукой
контролируют положение и продвижение фиброскопа, а левой манипулируют им. При
продвижении фибробронхоскопа в ротовую полость необходимо следить за тем,
чтобы бронхоскоп шел строго по средней линии, чтобы не попасть в периформную
ямку. Конец бронхоскопа после прохождения нижнего отдела шотки переводят в
переднею позицию и продвигают к надгортаннику.
После прохождения
надгортанника, голосовых связок и верификации колец трахеи конец бронхоскопа
устанавливают в нейтральную позицию. После этого ингубационную трубку сдвигают
с фиброскопа в трахею.
При большом сопротивлении
ингубационную трубку следует повернуть на 180° против часовой стрелки — для
облегчения прохождения через голосовые связки и контакта с передней комиссурой.
Ретроградная
интубация трахеи
Показания
Данная техника применяется в
том случае, если вышеописанные методики оказались безуспешными. Данная техника
применима у пациентов, находящихся в сознании и на самостоятельном дыхании.
Техника
После местной и
проводниковой анестезии дыхательных путей (как описано выше) крикотиреоидная
мембрана пунктируется в/в катетером размером 18G по средней линии. По
катетеру в ротовую полость проводят 80 см металлический проводник диаметром
0,025 дюйма или эпидураль-ный катетер. В/в катетер удаляют, металлический
проводник или эпидуральный катетер больной или выплевывает сам, или при помощи
ларингоскопа его выводят из ротовой полости, и по нему продвигают
интубационную трубку за голосовую щель.
Обеспечение проходимости дыхательных
путей в экстренной ситуации
Чрескожная игольчатая крикотиреотомия
Выполняется путем установки
в/в катетера размером 14G или 7,5F
интродъюссера через крикотиреоидную мембрану в просвет трахеи. Кислород
подается через соединения 3 мм адаптера ЭТТ непосредственно с в/в катетером или
через соединение 8,5 мм адаптера ЭТТ с корпусом 2 мл шприца, а затем с в/в
катетером. После установки катетера за ним необходимо постоянное наблюдение,
так как смещение катетера может привести к баротравме, обширной эмфиземе шеи и
передней поверхности грудной клетки и потере проходимости дыхательных путей.
Через катетер может быть
осуществлена оксигенация с потоком 10—12 л/мин, но не вентиляция. Это —
временное средство, и оно абсолютно противопоказано при полной обструкции
верхних дыхательных путей, так как может привести к баротравме.
Некоторое подобие струйной
вентиляции может быть осуществлено при использовании кнопки экстренной подачи
кислорода, когда подача кислорода осуществляется в течение 1 с, а спонтанный
выдох — в течение 2—3 с. При наличии соответствующей аппаратуры возможно
проведение высокочастотной ИВЛ.
Осложнения
Могут включать тканевую
энфизему, баротравму и пневмоторакс. Так как верхние дыхательные пути не
«защищены», возможна аспирация желудочного содержимого.
Крикотиреотомия
Это быстрый, простой и
безопасный метод при обструкции верхних дыхательных путей. При разогнутой шее
по средней линии в области крикотиреоидной мембраны делается поперечный разрез
скальпелем. Ручка скальпеля используется для от-сепаровки мягких тканей и
расширения щели до постановки трахеостомической или шпубационной трубки.
Регидная бронхоскопия
Необходима для обеспечения
проходимости дыхательных путей при инородных телах трахеи, при травматическом
повреждении трахеи, при стенозах. Очень важно иметь под рукой все размеры
жестких бронхоскопов (включая детский). Для индукции на самостоятельном дыхании
рекомендуется использовать ингаляционные анестетики.
Трахеостомия
Выполняется под местной
анестезией перед вводным наркозом у больных с заранее известной трудной
интубацией трахеи.
Техника
Разрез обычно выполняется по
третьему или четвертому кольцу трахеи. Это требует очень внимательного
рассечения сосудов, нервов и перешейка щитовидной железы.
Осложнения
Включают кровотечение,
ложный ход, пневмоторакс.
Специальные
дополнения
Быстрая последовательная индукция
Показания
Больные, недавно принимавшие
пищу (полный желудок), беременные, больные с высокой кишечной непроходимостью,
больные с высокой степенью ожирения или с симптоматическим рефлюксом.
Техника
Оборудование, необходимое
для быстрой последовательной индукции:
— работающий отсос;
— различные типы и размеры
клинков ларингоскопов (Макинтош и Миллер);
— различные ЭТТ на
проводниках, включая на один размер меньше чем в норме.
Ассистент
(сестра-анестезистка), который может выполнить прием Селика (давление на
перстневидный хрящ).
Пациент преоксигенируется
большим потоком 100%-го кислорода в течение 3—5 мин (денитрогенизация). Если
нет времени, то четыре вдоха, по объему равные полной жизненной емкости
легких, приводят к такому же результату.
Во время введения гипнотика
(тиопентал, пропофол, кетамин) и деполяризующего миорелаксанта ассистент выполняет
прием Селика. Данный прием позволяет предотвратить пассивную регурппацию,
уменьшить вентиляцию желудка при вентиляции маской, а также улучшает обзор
голосовых связок за счет смещения их в заднем направлении. Однако этот прием
не предотвращает регургигации при рвоте.
По возможности нужно
отказаться от вентиляции пациента маской. Интубация трахеи должна выполняться
за 30—60 сек. Прием Селика вьшолняется до тех пор, пока не будет верифицирована
правильная постановка эндотрахеальной трубки.
Если интубация неуспешна, то
прием Селика вьшолняется на протяжении всех последующих попыток интубации и при
вентиляции маской 100%-ным кислородом.
Замена интубационной трубки
Иногда необходима замена
интубационной трубки у больных, интубация которых представляла те или иные
сложности. Как правило, это необходимо из-за повреждения манжетки и
невозможности выполнения тампонады полости рта.
Санируется ротовая полость и
глотка. Пациент оксигениру-ется 100%-ным кислородом.
По старой интубационной
трубке мягкий проводник проводится в трахею. Старая интубационная трубка
удаляется, а новая по проводнику заводится в трахею. Проводник удаляется.
Альтернативной методикой может служить ишубация при помощи бронхоскопа. Новая
интубационная трубка надевается на бронхоскоп, который затем вдоль старой
ингубационной трубки проводится за голосовые связки. Манжетка на старой трубке
сдувается, и бронхоскоп проводится в трахею до момента определения хрящевых
колец трахеи для верификации позиции. Старая трубка удаляется, а новая
устанавливается в трахею так же, как описано ранее.
НЕКОТОРЫЕ ОСЛОЖНЕНИЯ, СВЯЗАННЫЕ С
ОБЕСПЕЧЕНИЕМ ПРОХОДИМОСТИ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Ключ к успеху лежит в
тщательном предоперационном осмотре, знании алгоритма действия, возможности
прибегнуть к посторонней помощи и в наличии современного оборудования.
Алгоритм действий
анестезиолога при неудачной интубации
|
Проблема |
Метод решения |
|
Первая попытка интубации неудачна |
Продолжить вентиляцию маской до следующей попытки
интубации (например, при помощи бронхоскопа) |
|
Все попытки неудачны |
Пациент должен быть пробужден |
|
Предыдущее невозможно из-за невозможности отменить
хирургическую операцию (экстренное Кесарево сечение) |
Должна быть продолжена вентиляция маской с
применением приема Селика |
|
Вентиляция маской затруднена или невозможна |
Обеспечить оксигенацию путем постановки
ларингеальной маски. Если несмотря на прилагаемые усилия насыщение
гемоглобина кислородом у пациента снижается, то необходимо немедленно
провести чрескожную игольчатую крикотиреотомию или хирургическую
крикотиреотомию |
Ларингоспазм
Наиболее частой причиной
ларингоспазма является раздражение рефлексогенных зон ротоглотки, трахеи или
бронхов в условиях поверхностной анестезии. Это может быть в результате попытки
итубации или попадания секрета, крови, желудочного содержимого или инородного
тела. Способствуют развитию ларингоспазма гипоксия, гиперкапния и ацидоз.
Рефлекторное смыкание голосовых связок вызывает появление «стридерозного»
дыхания. При полной обструкции анестезиолог не в состоянии вентилировать
пациента.
Терапия
— переход на ингаляцию 100%
кислородом;
— введение деполяризующих
мышечных релаксантов;
— санация
трахеобронхиального дерева;
— углубление анестезии.
Бронхоспазм
Бронхоспазм может быть как
проявлением генерализованной реакции организма (бронхиальная астма), так и
местного воздействия (как-то: ларингоспазм, реакция на интубацию и т.д.).
Бронхоспазм также может быть проявлением анафилактической или анафилактоидной
реакции организма на введение того или иного препарата. Кроме того, ряд
препаратов (морфин, тубарин, тракриум) могут провоцировать развитие
бронхоспазма из-за присущего им гистаминогенного эффекта.
Для бронхоспазма характерно
тахипноэ с затрудненным выдохом, при аускультации обнаруживается жесткое
дыхание. При возникновении бронхоспазма у пациента, находящегося в наркозе,
отмечается резкое увеличение давления на вдохе, увеличение сопротивления и
резкое уменьшение комплаенса.
Лечение
— верификация положения
ингубационной трубки. Раздражение карины может быть провоцирующим фактором в
развитии бронхоспазма;
— углубление анестезии. При
этом целесообразно использовать фторотан (галотан), так как последний является
весьма эффективным бронходилятатором. При проведении ТВА можно ввести кетамин,
так как он также обладает расслабляющим влиянием на мускулатуру бронхов ввиду
наличия симпатомиметических свойств. Однако можно использовать барбитураты и
пропофол. При гипоксии необходимо увеличить содержание кислорода во вдыхаемой
смеси;
— ингаляция
бронходилататоров (инсуфляция в дыхательный контур). Инсуфляция препаратов
позволяет минимизировать нежелательные эффекты препаратов на систему кровообращения
(изадрин, стероидные препараты);
— в/в препараты;
— симпатомиметики
стимулируют B2-адренорецепторы и активируют аденилатциклазу в
легких. Образовавшийся цАМФ вызывает расслабление гладкой мускулатуры бронхов:
— адреналин, при введении в
малых дозах (0,25—1,0 мкг/мин), воздействует преимущественно на (B2-рецепторы и, таким
образом, является эффективным брон-ходилататором;
— изопротеренол —
неспецифический B-агонист, вызывает тахикардию;
— метилксантины (эуфиллин) —
5 мг/кг каждые 30 мин, затем 0,5—1,0 мг/(кг/ч), но не более 0,5 мг в течение 4
ч. Побочный эффект — тахикардия.
— кортикостероиды
(преднизолон — 30—60 мг/кг; дексазон — 4—8 мг/кг; — целестон — 1—2
мг/кг);
— адекватное
увлажнение вдыхаемого газа.
Бронхиолоспазм — крайне тяжелое осложнение
интраоперационного периода. Развивается мгновенно, чаще всего в виде
аллергической реакции во время вводного наркоза.
Симптомы:
— «каменный» мешок. Резко
увеличивается давление на вдохе, при попытке перехода на ручную вентиляцию —
ощущение, что интубационная трубка окклюзирована;
— тотальный цианоз;
— дыхание в легких не
прослушивается.
При бронхиолоспазме очень
ограничено время от начала приступа до гипоксической остановки сердца. Как
правило, это происходит на 2—5 минуте. Так как анестезиолог редко сталкивается
с подобным осложнением, он начинает поиски места окклюзии, переинтубации
трахеи, что еще более сокращает время, отведенное на попытку вывести больного
из данного состояния.
Алгоритм действия анестезиолога при возникновении
бронхиолоспазма:
— немедленный перкуссионный
массаж грудной клетки, ритмичное и глубокое сдавление грудной клетки в попытке
имитировать дыхание;
— в/в введение высоких доз
стероидов (целестон — 2,0— 2,5 мг/кг);
— введение адреналина;
— введение в интубационную
трубку растворов муколи-тиков.
Несмотря на своевременность и
правильность проводимых мероприятий, смертность чрезвычайно высока и достигает
70—90%.
РОЛЬ
РЕГИОНАРНОЙ АНЕСТЕЗИИ
Регионарная анестезия может
служить методом выбора у пациентов с заведомо трудной интубацией. Однако
серьезные осложнения самой регионарной анестезии (потеря сознания, остановка
сердца из-за введения местных анестетиков интрава-зально) могут потребовать
интубации трахеи. Нарушение проходимости дыхательных путей может также
произойти из-за применения седативных и наркотических препаратов. Успешное
использование регионарной анестезии у больных с заведомо трудной интубацией
может быть обеспечено за счет использования катетерных техник (продленная
регионарная анестезия), тест-доз, незначительных возрастающих доз анестетика
для предотвращения возможной интоксикации. Адекватность блока должна проверяться
до начала операции, а план «отступления» (в случае развития неадекватности
блока во время операции, или в случае, если пациент не может больше находиться
в определенной позиции, или если операция затянулась) должен обсуждаться с
хирургом и пациентом заранее. Он может включать местную инфильтрационную
анестезию, перенос операции на другой день или использование техники интубации
в сознании для последующего проведения общей анестезии.
Рекомендуемая литература:
Латто И.П., Роузен М.
Трудности при интубации трахеи.—М.: Медицина.—1989.—303 с.
Mallampati S. et al. A clinical sign to predict difficult trachea!
intubation: A prospective study//Can. Anaesth. Soc. J.—1985.—V. 32.—№. 4.— Р. 429.
Глава 9
МОНИТОРИНГ
В.В. Лихеанцев
СТАНДАРТЫ МОНИТОРИНГА
Основная задача интраоперационного мониторинга — повышение безопасности во время общей анестезии и постоянный контроль функций, которые могут пострадать в результате проводимой операции или анестезии. Таким образом, условно можно разделить мониторинг на мониторинг безопасности и мониторинг состояния какой-либо системы пациента.
Основная тенденция
современного мониторинга — возможно более полный отказ от использования
инвазивных методик в том случае, если это идет не в ущерб безопасности
больного. В любом случае необходимо стремиться соблюдать баланс между реальной
пользой от использования того или иного исследования (тем более инвазивного или
сопряженного с использованием громоздкой, дорогостоящей аппаратуры) и
опасностью (а также трудозатратами), связанной с его проведением.
Согласно рекомендациям V
Всероссийского съезда анестезиологов и реаниматологов (Москва, 1996), признано
необходимым контролировать ЭКГ, пульсоксиметрию и проводить автоматическое
измерение артериального давления неинвазивным методом во время выполнения
любого оперативного вмешательства. Данный шаг следует признать весьма
полезным, но недостаточным.
Минимальный объем
мониторинга при любом виде общей анестезии должен включать:
— Электрокардиографию с
подсчетом ЧСС.
— Пульсоксиметрию.
— Измерение АД неинвазивным
методом.
— Термометрию.
— Капнографию с определением
содержания СО2 в конце выдоха (EtCO2).
— Содержание кислорода во
вдыхаемой смеси (FiO2).
— Контроль (ЧД).
— Минимальный объем
мониторинга при проведении регионарной анестезии или общей в анестезии с
сохраненным спонтанным дыханием должен состоять из:
— ЭКГ.
— Пульсоксиметрии.
— Измерения АД неинвазивным
методом.
— Контроля ЧД.
МОНИТОРИНГ СОСТОЯНИЯ СЕРДЕЧНО-СОСУДИСТОЙ
СИСТЕМЫ
Электрокардиография
Непрерывный контроль ЭКГ проводят
всем больным вне зависимости от типа оперативного вмешательства или варианта
анестезии для:
— обнаружения аритмий;
— определения ишемии
миокарда;
— обнаружения нарушений
электролитного баланса крови;
— мониторинга функции
кардиостимулятора;
— подсчета ЧСС.
Расположение электродов. Для контроля ЭКГ необходимо
иметь как минимум три электрода: два активных и один электрод сравнения
(«земля»). ЭКГ-сигнал достаточно маломощный (порядка 1 мВ), и поэтому на запись
ЭКГ существенное влияние оказывают использование электрокоагулятора, движения
больного и т.д. Необходимо по возможности уменьшить сопротивление под
электродом, для чего тщательно смазанный электропроводным гелем электрод
накладывается на чистую, предварительно обезжиренную кожу.
При работе с трехэлектродным
кабелем ЭКГ имеет смысл проводить постоянный мониторинг либо:
— во II
стандартном отведении — оптимальное отведение для обнаружения и определения
вида аритмий;
— в отведении V5 — для
контроля ишемии миокарда, так как именно в этом отведении контролируется
наибольшая по объему часть левого желудочка.
Еще более целесообразно
мониторировать модифицированное отведение V5. При этом электроды
располагают:
— «правая рука» — справа под
ключицей;
— «левая рука» — в положении
V5;
— «левая нога» — в обычном
месте.
У пациентов с заболеваниями
сердца имеет смысл проводить мониторинг ЭКГ в двух отведениях одновременно (II
стандартном и V5), для чего необходимо иметь пятижильный кабель. Данное
расположение электродов позволяет выявить до 80—96% случаев ишемии миокарда,
против 75—80% — при использовании только V5, или 18— 33% при использовании
только II стандартного отведения. Большинство современных мониторов имеет выбор
из двух возможностей анализа ЭКГ:
— «диагностическую» — при
этом современный монитор производит автоматический анализ смещения сегмента ST, выявления и анализ аритмий.
Недостатком является фильтр с достаточно широкой полосой пропускания (0,05—100
Гц). Анализ смещения сегмента ST во многом зависит от защиты прибора от
работы электрокаутера и других электрических помех в операционной. Если еще 5—7
лет назад данный анализ в операционной был практически нереален, то современные
мониторы (AS3/TM, Datex, Финляндия) позволяют
проводить подобный контроль достаточно надежно и эффективно;
— в «режиме мониторинга» —
более узкая полоса пропускания (0,5—100 Гц), а следовательно, большая устойчивость
к шумам и более удобно следить за нарушениями ритма.
Измерение
артериального давления
Определение артериального
давления неинвазивным методом. В настоящее время большинство мониторов оснащено
блоком для измерения АД неинвазивным методом. При этом прибор раздувает манжету
с запрограммированной врачом периодичностью и измеряет АД осциллометрическим
методом. Как правило, точность автоматических приборов сравнима с измерением
АД прямым методом.
На точность измерения влияют
движения пациента, неправильно выбранный размер манжеты, сдавление манжеты
извне. Некоторые приборы имеют режим непрерывного измерения АД, т.е. сразу по окончании
измерения цикл повторяется. Данный режим очень удобен во время вводного наркоза
или при нестабильной гемодинамике, однако им не следует злоупотреблять, так
как слишком длительное измерение АД в подобном режиме приводит к нарушению
сначала венозного, а затем и артериального кровообращения конечности.
Обычная кратность измерения
АД — 1 раз в 5 мин. Наконец, есть приборы, позволяющие не только измерять АД в
непрерывном режиме, но и моделировать на дисплее кривую артериального давления.
Данные приборы достаточно хорошо работают при относительно стабильном АД,
однако моделированные кривые, по крайней мере пока, могут существенно
отличаться от истинных при резких колебаниях давления.
Прямое измерение
артериального давления. В ряде случаев, когда есть основания предполагать существенные колебания
АД во время операции, имеет смысл избрать метод его прямого измерения. В
необходимый набор для измерения АД инвазивным методом входят:
— артериальная канюля.
Канюляция артерии может производиться двумя способами: пункционно и путем артериосекции.
Для обеспечения доступа используют, как правило, a. radialis:
— электронный датчик прямого
измерения АД с одноразовой или многоразовой камерой («домиком») и артериальной
магистралью (соединяющей «домик» и канюлю), заполненные стерильным раствором.
Датчик предварительно выводится на «О» и калибруется в соответствии с
инструкциями к монитору. Промывание датчика производится либо в автоматическом
режиме, либо с необходимой кратностью, с тем, чтобы не допустить тромбоза
измеряющей магистрали и попадания крови в «домик».
Некоторые правила определения
АД инвазивным методом:
— перед постановкой
артериальной канюли проводят пробное пережатие лучевой артерии (проба Аллена),
с тем, чтобы убедиться, что кровоснабжение кисти сохраняется за счет анастомозов
с веточками a. ulnaris;
— если катетер устанавливают
повторно, место пункции следует выбрать проксимальнее предыдущей. Если ранее
проводилась артериосекция, имеет смысл использовать для повторной канюляции
контрлатеральную конечность;
— для корректного измерения
необходимо следить за отсутствием в магистралях воздуха, тромбов, перегибов и
т.д. Магистраль не должна быть слишком длинной, чтобы не искажать результатов
измерения («демпфированная» кривая);
— датчик измерения АД следует
располагать на одном уровне с артерией.
Измерение центрального
венозного давления
Измерение центрального
венозного давления (ЦВД) производится через катетер, установленный в
подключичной или внутренней яремной вене, по правилам, изложенным для измерения
инвазивного АД.
Другой метод измерения ЦВД
предусматривает соединение с катетером через трех- или двухходовой краник специальной
полой измерительной линейки, заполненной стерильным раствором (метод
Вальдмана). «0» в данном случае устанавливается по передней подмышечной линии
больного, что соответствует уровню правого предсердия. ЦВД определяют по
высоте столба жидкости (по закону сообщающихся сосудов).
Измерение
давлений в полостях сердца
В ряде случаев стандартный
мониторинг безопасности необходимо расширить и производить измерение давлений в
легочной артерии (PA — pulmonary artery),
включая давление заклинивания легочных капилляров (PCW — pulmonary capillary wedge pressure), правом предсердии (CVP — central vein pressure), правом желудочке (RV — right ventricle), минутного выброса сердца (СО — cardiac output), так называемый полный инвазивный мониторинг.
Для проведения полного
инвазивного мониторинга необходимо установить катетер Сван-Ганц. Последний имеет
каналы для измерения давлений (два — в легочной артерии и правом предсердии),
термистор (для определения минутного выброса сердца). Последние модификации
катетера (Baxter, USA; Abbott, USA) имеют дополнительные
каналы:
— или оптоволоконный, для
измерения насыщения смешанной венозной крови кислородом в режиме on line;
— или термонагреватель —
позволяет измерять МОС в режиме on line.
Катетер имеет деления через
каждые 10 см.
Показания к полному инвазивному мониторингу
— Пациенты с нарушением
насосной функции сердца.
— Пациенты с тяжелой
ишемической болезнью сердца.
— Пациенты с тяжельм
поражением клапанного аппарата сердца.
— Пациенты с сочетанным
заболеванием: ИБС и нарушением проводимости (на фоне которого по данньм ЭКГ
трудно установить возникновение ишемии миокарда), например, ИБС на фоне
блокады левой ножки пучка Гиса).
— Пациенты, которые
нуждаются в пейсмекере интраоперационно (катетер Сван-Ганц, совмещенный с
эндокардиальным электродом).
— Пациенты с полиорганной
недостаточностью (сепсис, шок, РДС, почечная недостаточность).
— Пациенты, у которых
оперативное вмешательство однозначно вызывает серьезные физиологические сдвиги
(пациенты с торако-абдоминальной аневризмой или предполагаемой
трансплантацией органов).
Полный инвазивный мониторинг
позволяет наиболее рано и точно диагностировать нарушения сократимости
миокарда, поражение клапанов сердца, аритмию, легочную гипертензию. PCW
достаточно четко коррелирует с давлением заполнения левого желудочка, а,
следовательно, по его величине можно судить о преднагрузке левого желудочка и
волемическом статусе пациента.
Установка
катетера Сван-Ганц
Доступом через центральную
или крупную периферическую вену под контролем кривой давления по магистрали
легочной артерии проводят катетер до правого предсердия и далее до правого
желудочка (рис. 9.1).
Появление характерной «желудочковой» кривой с высокими
пиками и отсутствием диастолического давления является достоверным признаком
нахождения кончика катетера в правом желудочке. Раздувают воздушный баллончик
и с током крови стремятся продвинуть катетер в легочную артерию: появление
«артериальной» кривой с ясно определяемой диастолой и характерным смещением в
зависимости от фазы дыхательного цикла свидетельствует о нахождении катетера в
легочной артерии. Катетер продвигают до исчезновения кривой («заклинивание»
катетера), после чего удаляют воздух из баллончика и убеждаются, что кривая
давления появляется вновь. Повторно раздув баллончик, измеряют PCW.

Рис. 9.1. Характерные кривые
в зависимости от положения катетера Сван-Ганц в различных полостях сердца
Осложнения
катетеризации полостей сердца
1. Аритмия. При прохождении
кончика катетера через правое предсердие и правый желудочек могут возникать
различного рода нарушения ритма, чаще всего — экстрасистолия. Наиболее
вероятно развитие аритмий у лиц с нарушениями сердечного ритма в анамнезе.
При возникновении аритмий
целесообразно использовать введение 2%-го раствора лидокаина; у лиц с
аритмическим анамнезом лидокаин вводится профилактически.
2. Может наблюдаться
преходящая блокада правой ножки пучка Гиса. У пациентов с а.-в. блокадой первой
степени или у больных с блокадой левой ножки пучка Гиса проведение катетера
может спровоцировать развитие полной поперечной блокады. В этом случае должна
быть полная готовность к проведению электрокардиостимуляции одним из вышеописанных
способов (наружной или через трансвенозный доступ).
3. Нельзя держать воздушный
баллон катетера постоянно раздутым из-за опасности развития пролежня стенки
легочной артерии или инфаркта легкого. Раздувать баллон необходимо только на
время измерения PCW.
4. Очень редко, но возможно
скручивание катетера в полости сердца с образованием узла или подшивание
(прошивание) катетера при выполнении операции на сердце.
5. Возможны осложнения, общие
с осложнениями при катетеризации центральных вен.
Определение
МОС (СО)
Сердечный выброс и сердечный
индекс (СИ=МОС/площадь поверхности тела) — одна из ведущих констант организма.
только определение СИ (СI) позволяет оценить сократимость
миокарда и количественно оценить сердечную недостаточность. Существует несколько
способов определения минутного выброса сердца.
Метод Фика. Расчет производится по
формуле, компонентами которой являются потребление кислорода и
артерио-венозная разность по кислороду.
Метод разведения красителя. Точно известное количество
инертного красителя (кардиогрин) вводится в центральную вену, а в артериальной
пробе определяется его концентрация. Несложный расчет дает величину МОС.
Имеются приборы с ушным
датчиком, которые позволяют регистрировать на бумаге кривую разведения
красителя и автоматически рассчитывать величину МОС.
Известным ограничением метода
является невозможность частого повторения измерений из-за накопления красителя
в крови.
Метод ультразвуковой
доплерографии.
Датчик, расположенный эндопищеводно и сориентированный на грудную аорту,
измеряет линейную скорость кровотока по аорте. Затем на основании
антропометрических данных определяется диаметр аорты и производится расчет
объемной скорости кровотока. Метод привлекателен ввиду неинвазивности, однако
по понятным причинам недостаточно точен.
Метод тетраполярной
реографии. Имеет те же преимущества (неинвазивность), но и те же недостатки, что
и предыдущий вариант. Ошибка метода чаще всего превышает 20%, что делает
измерение, по сути дела, бессмысленным.
Метод прямой флоуметрии. Наиболее точный метод
измерения МОС. Однако измерение данным методом можно проводить только при
строго ограниченном круге операций и только на определенных этапах, так как
необходимо установить датчик электромагнитного флоуметра (точно подобранный по
размеру) на корень аорты или легочной артерии. Кстати, на разности показаний
датчиков, установленных на корне аорты и легочной артерии одновременно,
основан один из методов измерения коронарного кровотока.
Метод термодилюции. Один из самых точных
методов, лишенный недостатков флоуметрии. Для проведения измерений необходим
катетер Сван-Ганц. Заранее известное количество охлажденного раствора быстро
вводится через венозный порт. Термистор, расположенный на конце катетера,
регистрирует разность температур и на основании кривой термодилюции
рассчитывает величину МОС.
При проведении исследования
необходимо помнить о следующих правилах:
— если прибор для измерения
МОС не распознает автоматически тип катетера, необходимо выставить на мониторе
калибровочное число используемого типа катетера;
— если введено меньшее
количество раствора, чем это выставлено на мониторе, результат измерений
превысит истинное значение МОС;
— при использовании современных мониторов температура вводимого раствора не имеет значения. Она может стать причиной ошибки, только если термистор перестает регистрировать разницу температур. Например, при использовании слегка подогретого раствора (24—25° С) у пациентов, находящихся в состоянии гипотермии. В этом случае возможна ошибка измерения, или прибор сообщит о возникших проблемах;
— наличие внутренних шунтов
в сердце искажает результаты измерения (например, дефект межжелудочковой
перегородки);
— быстрое введение
неподогретых растворов через центральную вену одновременно с проведением измерения
искажает результат последних;
— правильнее проводить
измерение МОС в конце выдоха, для чего необходимо отсоединить пациента от ИВЛ
на время проведения измерения. Более современные мониторы (ass/tm, Datex, Финляндия) автоматически
синхронизируют измерение с концом выдоха. Истинным следует считать средний
результат трех последовательных измерений.
Определение
МОС в режиме on
line
В настоящее время фирмами Baxter
(США) и Abbott (США) разработаны и производятся катетеры для
непрерывной регистрации сердечного выброса. Спираль, расположенная
проксимальнее термистора, подогревает омьшающую кровь. Разность температур до и
после подогрева регистрируется прибором. Это значительно расширяет возможности
обсуждаемого метода.
Определение REF
Также новой возможностью
является измерение фракции выброса правого желудочка (REF — right ejection fraction). Необходимым условием для
измерения данной величины является катетер типа Сван-Ганц с термистром с низкой
постоянной времени (Fast Termistor) и математической программой
наложения ЭКГ на кривую термодилюции. Измерение REF, ценное само по себе,
позволяет определить и конечно-диастолический объем (КДО), и КД1 (КДО/ППТ)
правого желудочка. Последний показатель, равный в норме 105—115 мл/м2,
является прямьил методом контроля воле-мического статуса пациента.
Данная возможность реализована в настоящее время в приборах фирмы АВВОТТ
(«Оксиметрик», США), Baxter («Explorer», США), Datex ASS/тм
(Финляндия).
МОНИТОРИНГ
ДЫХАНИЯ
Пульсоксиметрия
Система дыхания, включая
внешнее дыхание и систему транспорта кислорода, является, наряду с
сердечно-сосудистой системой, наиболее важной для поддержания жизнедеятельности
организма. После газообмена в легких кислород переносится тканям в связанном с
гемоглобином виде и в виде растворенного в плазме. Вклад последнего в общий
транспорт кислорода минимален, что очевидно из следующей формулы:
CaО2=
[(l,37)-(Hb)х(SaO2)] + [(0,003)-(РаО2)],
где 1,37 — количество мл
кислорода, связанного с полностью оксигенированной молекулой гемоглобина;
Hb —
концентрация гемоглобина (г/дл);
SaO2 — насьпцение артериальной
крови кислородом;
0,003 — константа
растворимости кислорода в плазме;
РаO2 — парциальное давление
кислорода в плазме крови. В этой связи представляется чрезвычайно важным
мониторировать насыщение кислородом гемоглобина артериальной крови. Методом,
позволяющим производить подобные измерения в режиме on line,
является пульсоксиметрия. Метод основан на разном поглощении света
оксигемоглобином в видимом красном и инфракрасном диапазонах. Свет, излучаемый
двумя светодиодами, попадает на сенсор, проходя через капиллярное ложе (чаще
всего ногтевая фаланга или мочка уха). Количество света, попадающее на сенсор,
зависит от:
— пульсовой волны, так как
во время систолы поглощение возрастает в обоих диапазонах вследствие увеличения
количества крови в капиллярном русле, а, следовательно, и количества
гемоглобина;
— изменения концентрации
гемоглобина или оксигемоглобина, что, собственно, и регистрирует метод.
Следует помнить, что
измерение возможно только во время пульсирующего кровотока, что позволяет
проводить пуль-соксиметрию именно артериальной крови. Однако с указанным
свойством связаны и некоторые ограничения, например, пуль-соксиметр не
работает при плохой микроциркуляции (шок, сепсис, глубокая гиповолемия,
гипотермия, искусственное кровообращение). Кроме того, все пульсоксиметры
калиброваны эмпирически (на добровольцах), и потому точность измерения при
насыщении ниже 70% резко снижается.
Возможные причины снижения
сатурации
Пациент
— низкая FiO2;
— неадекватная вентиляция;
— плохая микроциркуляция (см.
выше);
— появление патологического
гемоглобина (метгемоглобин, карбоксигемоглобин, сульфгемоглобин);
— введение красителя
(кардиогрин, метиленовый синий);
— венозны застой;
— отсутствие пульсирующего
кровотока (искусственное кровообращение);
— движения
пациента.
Монитор
— электрическая интерференция
(работа электрокаутера);
— наличие добавочных
источников инфракрасного излучения (для устранения можно накрыть датчик
пульсоксиметра непрозрачным материалом — салфеткой, простыней и т.д.);
— технические дефекты датчика
или кабеля.
Непрерывное
определение насыщения крови кислородом
В настоящее время выпускаются
катетеры, снабженные оптоволоконным каналом, позволяющие определять насыщение
кислородом крови в том месте сосудистого русла, где установлен катетер.
Одновременное проведение пульсо-ксиметрии и оксиметрии смешанной венозной крови
позволяет рассчитать основные показатели кислородтранспортной функции крови и
мониторировать их в режиме on line. Таким образом, появилась
возможность оценить соотношение транспорта и потребления кислорода в реальном
масштабе времени. Ценность подобной опции для практики анестезиолога трудно
переоценить.
Пока невозможно предположить
все области анестезиологии-реаниматологии, где может найти применение указанный
метод. Однако уже сейчас он используется для:
— контроля гипоксии мозга во
время операций на сонных артериях. Катетер устанавливается во внутреннюю яремную
вену);
— оценки степени реперфузии
тканей после снятия зажима с аорты при протезировании аорты и ее ветвей.
Капнометрия
Исследование содержания
углекислого газа в конце выдоха (EtCO2) производится при любом виде
анестезии, в том числе и для контроля правильности интубации трахеи, правильности
выбора параметров ИВЛ и для обнаружения некоторых патологических состояний:
злокачественной гипертермии, эмболии легочной артерии. Как правило, значения EtCO2 на несколько мм рт. ст. ниже
соответствующих значений артериальной крови и довольно точно коррелируют с ними
при большинстве клинических ситуаций. В то же время внутрилегочное шунтирование
крови, значительное увеличение мертвого пространства и колебания легочного
кровотока могут изменить артериальную разницу в конце выдоха таким образом,
что EtCО2 перестанет точно отражать
изменения РаСО^. В указанных случаях необходим контроль газового состава
артериальной крови.
Значительно расширяет
диагностические возможности капнометрии регистрация кривых содержания СО2 (рис. 9.2).
Капнография позволяет выявить
следующие состояния:
— негерметичность контура;
— неисправность клапана вдоха
или вьщоха;

Рис. 9.2. Некоторые
капнограммы, часто встречающиеся в практической работе:
1 — быстро убывающая кривая,
характерная для ошибочной интубации пищевода; 2 — разгерметизация дыхательного
контура; 3 — регулярные падения в конце конечно-экспираторного плато,
характерные для гипервентиляции или для пациентов, с восстановлением
нервно-мышечной проводимости; 4 — изменение формы капнограммы и уменьшение
выделения СО; указывает на редукцию кровотока через легкие в результате
снижения сердечного выброса; 5 — смещение кривой вверх от изолинии,
свидетельствующее о попадании углекислого газа во вдыхаемую смесь (контроль
адсорбента); 6 — рестриктивное заболевание легких; 7 — обструктивное
заболевание легких; 8 — кардиогенные осцилляции
— неработающий адсорбер;
— обструкцию в дыхательном
контуре;
— быстрое нарастание уровня
СО2 (является одним из ранних
признаков злокачественной гипертермии);
— состояние гипоперфузии —
шок;
— эмболию легочной артерии;
— затрудненный выдох
(бронхиальная астма, инородное тело, экстрапульмональная компрессия);
— внутрилегочное шунтирование
крови;
— адсорбцию углекислоты из
брюшной полости во время выполнения лапароскопических вмешательств;
— реперфузию, после снятия
турникета с аорты;
— один из ранних признаков
восстановления нервно-мышечной проводимости после медикаментозной блокады.
Спирометрия
в боковом потоке
В настоящее время ряд
мониторов позволяет мониторировать некоторые показатели механики дыхания,
используя для анализа минимальные объемы газа из контура пациента — метод,
получивший название «Side Stream Spirometry».
С помощью указанного метода достаточно точно можно определить:
— податливость, растяжимость
(Compliance) легких — значение данного показателя для
диагностики рестриктивных заболеваний легких и выраженности РДС-синдрома
обсуждалось в соответствующей главе;
— аэродинамическое
сопротивление на вдохе — данный показатель весьма эффективно позволяет
диагносцировать обструкцию в контуре или дыхательных путях пациента;
— получать на дисплее
монитора кривые поток/объем и объем/давление, сравнивать их во времени и таким
образом мониторировать механику дыхания (рис. 9.3, 9.4).
Определение
FiO2
и концентрации ингаляционных анестетиков
Большинство современных
наркозно-дыхательных аппаратов позволяет мониторировать процентное содержание
кислорода во вдыхаемой смеси. Это необходимо, так как позволяет
контролировать состав газонаркотической смеси и вовремя определить его гипо- и
гипероксический характер.

1. интубациояная трубка, диаметром 6 мм.
2 . Иятубационная трубка диаметром 9 мм.
Рис. 9.3. Кривая поток/объем

Хороший комплайнс

Рис. 9.4. Кривая
объем/давление
Непрерывный контроль
содержания ингаляционных анестетиков в подаваемой смеси и контуре пациента
особенно необходим
при проведении ИВЛ по методике Low или Minimum Flow, так как позволяет:
— в начале наркоза
определить истинную концентрацию анестетика в контуре, которая может быть
существенно ниже, чем концентрация анестетика в подаваемой смеси или той,
которая выставлена регулировочной ручкой как желаемая;
— в период поддержания и
окончания анестезии, когда складывается обратная ситуация.
Некоторые современные
наркозно-дыхательные аппараты (например, ADU, Datex-Engstrom, Финляндия) позволяют сразу
рассчитать МАК (минимальную альвеолярную концентрацию), что очень удобно,
особенно для начинающего анестезиолога.
ТЕРМОМЕТРИЯ
Термометрия является
непременным компонентом современного мониторинга при любом типе оперативного
вмешательства. Необходимость в термометрии диктуется следующими обстоятельствами:
— контроль за возникновением
злокачественной гипертермии;
— у детей относительно высок
индекс площади поверхности тела к массе тела. Мониторинг температуры у данного
контингента особенно показан еще и в связи со слабо развитой системой
терморегуляции;
— у всех пациентов потеря
тепла с открытой раны, переливание инфузионных растворов различной
температуры, использование термоматраца (или без него) вызывают необходимость
в интраоперационной термометрии.
Для измерения температуры
приняты следующие точки:
— кожная температура. Следует
иметь в виду, что при длительных операциях температура кожи может быть на
3—4°С ниже внутренней температуры тела;
— в подмышечной впадине.
Редко используется для рутинного мониторинга. Может быть на 1°С ниже
внутренней температуры тела;
— ректальная температура.
Достаточно точно отражает изменения температуры тела и может быть использована
для мониторинга во время анестезии;
— температура пищевода. Достаточно
точно отражает изменения температуры тела и может быть использована для
мониторинга во время анестезии;
— температура в носоглотке.
Достаточно точно отражает изменения температуры тела. Наиболее часто
используется для мониторинга во время анестезии;
— при наличии катетера
Сван-Ганц используют имеющийся термистор для измерения температуры.
— температура наружного
слухового прохода. Достаточно точно отражает внутричерепную температуру.
Глава 10
ОБЩАЯ АНЕСТЕЗИЯ
В 1996 г. исполнилось 150
лет первому наркозу, проведенному Мортоном в Бостоне эфиром, который,
как известно, является парообразующим или ингаляционным анестетиком. Длительные
годы вслед за этим эфир оставался практически единственным средством для
проведения общей анестезии.
Ситуация коренным образом
изменилась после основополагающих работ Де Кастро 50-х годов нынешнего
столетия, в которых разрабатывалась теория нейролепсии, или нейролептаналгезии.
В результате неоднократных трансформаций и модификаций эта теория привела к
созданию современной концепции многокомпонентной сбалансированной анестезии
(МСА). Различные варианты МСА: НЛА, атаралгезия, тотальная внутривенная
анестезия (ТВА) и т.д. настолько прочно укоренились в нашей стране, что,
казалось, напрочь вытеснили саму идею использования летучих анестетиков в
практической анестезиологии, может быть, за исключением детской
анестезиологии.
Следует отметить, что для
этого были определенные основания: ведь единственно доступному в нашей стране
ингаляционному анестетику — галотану (фторотану) — инкриминировались
следующие недостатки:
— высокая токсичность как
для больного, так и для персонала, находящегося в операционной. Действительно,
фторотан вызывает дозазависимую депрессию сердечно-сосудистой системы и
дыхания, увеличение мозгового кровотока и внутричерепного давления, обладает
гепато- и нефротоксичностью;
— кроме того, несовершенная,
часто значительно изношенная наркозно-дыхательная аппаратура с негерметичным
контуром приводила и приводит к загрязнению операционной отнюдь не безвредными
парами галотана.
— недешевый сам по себе,
галотан (а тем более эн- и изо-флюран) для точности дозировки требует хороших и
дорогих испарителей, которые в нашей стране не производились и не производятся
(отечественные испарители для галотана и энфлюрана рассчитаны только на большие
газовые потоки, а испарителей для изофлюрана вообще нет).
Вместе с тем в развитых
западных странах даже появление нового мощного в/в анестетика дипривана не
привело к отказу от ингаляционной анестезии. Так, по данным 1995 г., 65%
операций в Германии, 75 — во Франции и 73% — в США проведены в условиях общей
ингаляционной анестезии. Это не может не наводить на определенные
размышления.
Учитывая, что наиболее
прогрессивной методикой МСА признается ТВА на основе дипривана и альфентанила,
попробуем сравнить эти препарат и ингаляционные анестетики с так называемым идеальным
анестетиком.
Свойства идеального
анестетика:
— должен вызывать быструю и
комфортабельную индукцию. Здесь определенное преимущество имеют в/в анестетики — диприван и
барбитураты. За исключением педиатрии ингаляционные анестетики для вводного
наркоза в настоящее время не используются;
— длительность анестезии
должна быть легко контролируема. До настоящего времени это значительно
легче достигается с помощью ингаляционого анестетика. Лучшее понимание
фармакокинетики и фармакодинамики в/в препаратов и проведение TCI (Target Control Infusion — инфузия, контролируемая
по «мишени»), может быть, в будущем изменит сложившуюся ситуацию;
— глубина анестезии
должна быть легко измеряема и изменяема. Конечно, гораздо легче
контролировать глубину анестезии при использование ингаляционных анестетиков,
однако быстрее углубить наркоз можно только при использовании в/в препаратов;
— способ введения препарата
должен быть максимально прост. По сравнению с ингаляционной анестезией,
требующей сложной и дорогостоящей наркозно-дыхательной аппаратуры, испарителя и
монитора, способ введения в/в препаратов предельно прост. Это стало особенно
очевидно после появления инфузионных насосов и методики TCI;
— препарат по возможности
не должен иметь побочных эффектов. К сожалению, как в/в анестетики, так и
галогенсодержащие парообразующие препараты обладают побочными эффектами. Так,
хорошо известно кардиодепрессивное действие ингаляционных агентов, присущее
даже самым современным препаратам, таким, как сево- и дезфлюран. Поэтому они с
осторожностью должны использоваться у лиц с гиповолемическим шоком или
скомпрометированной сердечно-сосудистой системой. В данном случае методом
выбора является использование высоких доз опиовдных аналгетиков. Последние, в
свою очередь, вызывают выраженную депрессию дыхания, что может осложнить
течение раннего послеоперационного периода;
— у препарата не должно
быть токсических метаболитов. Как уже говорилось раньше, распад галотана
сопровождался появлением значительного количества токсических метаболитов,
приводящих иногда даже к развитию некроза печени. Современные ингаляционные
анестетики практически не метаболизируются в организме, а выводятся легкими в
неизменном виде. В этой связи риск появления токсичных метаболитов сведен к
минимуму и сравним с таковым при применении в/в препаратов (рис. 10.1);
— выведение препарата не
должно быть связано с функцией печени или почек. Современные ингаляционные
анестетики в неизменном виде выводятся легкими, чего нельзя сказать о в/в
препаратах. Элиминация последних в той или иной степени протекает в указанных
органах;
— действие препарата
должно быть достаточно специфичным. Излишне говорить, что в/в препараты
обладают гораздо более выраженной селективностью действия;
— препарат должен
обладать достаточной широтой терапевтического действия. Эта проблема более
актуальна для в/в анестетиков.

Рис. 10.1. Метаболизм газовых
анестетиков в печени
Таким образом, сравнение в/в
и ингаляционных анестетиков по меньшей мере свидетельствует о наличии баланса
положительных и отрицательных свойств тех и других. Однако если учесть, что
сейчас редко кто проводит мононаркоз ингаляционным анестетиком, то можно
предположить, что разумное сочетание преимуществ изо-, дез- и севофлюрана с
таковыми препаратов группы фентанила может обеспечить максимальный
положительный эффект при анестезиологическом обеспечении особенно длительных и
травматичных операций.
Действительно, если в
«хирургии одного дня» в первую очередь необходимы недорогая аппаратура,
комфортность пробуждения, быстрота углубления анестезии и не имеют
существенного значения такие факторы, как гарантированная глубина анестезии,
отсутствие связи элиминации препарата с функцией печени и почек и т.д., то при
обеспечении длительных и травматичных операций ситуация меняется с точностью до
наоборот.
Таким образом, при всех
преимуществах ТВА на основе дипривана и фентанила в «малой» хирургии,
представляется, что анестезиологическое пособие длительных и травматичных операций,
по крайней мере, пока, как необходимый компонент, должно включать
использование современного парообразующего анестетика. Последнее позволит
сделать анестезию более надежной, управляемой и защитит пациента от более чем
нежелательного пробуждения во время анестезии или наличия у него сознания на
этом этапе.
Глава 11
МНОГОКОМПОНЕНТНАЯ
АНЕСТЕЗИЯ
НА ОСНОВЕ
ВНУТРИВЕННЫХ ПРЕПАРАТОВ
А.И. Салтанов
Компоненты общей анестезии,
используемые для реализации конкретного эффекта, как правило, являются внутривенными
препаратами. В англоязычной литературе широкий круг лекарственных средств,
применяемых в анестезиологии (гипнотики, аналгетики), называют внутривенными
анестетиками (intravenous anaesthetics).
С их помощью создаются различные схемы общей сбалансированной анестезии (balanced anaesthesia — ВА) или тотальной внутривенной
анестезии (total intravenous anaesthesia — TIVA).
Внедрение в современную
практику препаратов ультракороткого действия придает внутривенной анестезии
все более управляемый характер и в этом плане приближает ее к ингаляционной,
чему способствует и техническая разработка инфузионных систем, обеспечивающих
максимально точное дозирование лекарственных средств, в том числе с
возможностью компьютерного программирования инфузии (Target controlled infusion — ТСI).
Практически реализована
концепция Prys Roberts (1979) о минимальном уровне
инфузии препарата (minimum infusion rate — MIR), т.е. о минимальной дозе
препарата, способной подавлять двигательную активность у 50% пациентов в ответ
на разрез кожи (ЕD50). Эта величина имеет бесспорную аналогию с широко
принятой константой, характеризующей активность ингаляционного анестетика —
минимальной альвеолярной концентрацией (minimum alveolar concentration — MAC).
Важным аспектом современной
комбинированной анестезии на основе внутривенных препаратов являются учет и разумное
использование их синергических и антагонистических свойств. В современных
схемах широко используется принцип не только потенцирования основных свойств
лекарственных средств, но и коррекции побочных эффектов. В свое время Р. Janssen
точно подобрал соотношения частей дроперидола и фентанила (50:1) с целью
взаимной коррекции побочного действия этих препаратов; хорошо известно влияние
диазепама на профилактику и коррекцию побочных эффектов кетамина.
В данной главе представлены
главным образом новые средства. Некоторые препараты, ставшие традиционными и рутинными
в анестезиологической практике и подробно описанные в руководствах и учебниках
(тиопентал, гексенал, морфин, фентанил), будут представлены только в аспекте
сравнения основных и побочных эффектов с современными средствами общей
анестезии. Миорелаксантам посвящена соответствующая глава руководства.
Гипнотики
Большинство препаратов с
гипнотическим действием, применяемых в анестезиологии, лишено какой-либо
аналгетической активности, за исключением стероидных производных, обладающих
слабыми аналгетическими свойствами. Механизм воздействия на ЦНС связан, как
правило, с торможением активности ретикулярной формации среднего мозга через
систему ГАМК.
Общей тенденцией современной
фармакологии стала разработка препаратов ультракороткого действия, обеспечивающих
управляемость гипнотического эффекта, отсутствие кумуляции и токсичности,
минимальные побочные эффекты, совместимость с другими компонентами общей
анестезии. Это достигается появлением в клинической практике новых барбитуратов
(метогекситал натрия), небарбитуровых гипнотиков (этомидат, пропофол), бензодиазепинов
(флунитрозепам, мидазолам).
Барбитураты
Метогекситал натрия (бриетал, бревиметал) —
гипнотик короткого действия, применяющийся как для индукции, так и для
проведения кратковременной самостоятельной анестезии. Имеет преимущества перед
гексеналом и тиопенталом (более быстрый и плавный гипнотический эффект,
пробуждение без остаточной депрессии). Применяется в дозе 1,0—1,5 мг/кг (всего
80—150 мг) для индукции. Создает быстрое наступление гипнотического эффекта,
длящегося не более 5—7 мин. По данным некоторых авторов, бриетал в
индукционной дозе более 1 мг/кг способен вызвать существенные колебания
гемодинамических показателей у больных с выраженной гиповолемией. В связи с
этим рекомендуют вводить препарат медленно (1 мл 1%-ного раствора за 5 сек.). При
самостоятельном наркозе повторное введение метогекситала натрия осуществляют в
дозах 20—40 мг. Препарат может применяться в виде инфузии для поддержания
анестезии, однако в современной анестезиологии для этой цели используют, как
правило, небарбитуровые гипнотики.
Небарбитуровые
гипнотики
Кетамин (калипсол, кетанест)
достаточно хорошо известен, хотя этот препарат до сих пор является предметом
всестороннего экспериментального и клинического изучения. Синтезирован в 1965
г. Оказывает анестезирующее (наркотизирующее) и аналгетическое действие.
Анестезия кетамином получила название «диссоциативной», так как препарат
угнетает преимущественно ассоциативные зоны коры и таламуса (В.Д. Машковский,
1993). Существует и другая трактовка термина «диссоциативная анестезия»:
имеются в виду торможение одних отделов ЦНС (кора, ретикулярная формация) и
возбуждение других (лимбическая система); последнее обусловливает побочные
эффекты (в частности, галлюцинации). Метаболизирует путем деметилирования;
основная часть метаболитов выделяется с мочой в течение 2 ч (меньшая часть
может оставаться в организме несколько дней); кумуляция при многократном
введении не наблюдается.
Помимо применения как
самостоятельного анестетика (1,5—2 мг/кг в/в), кетамин в последние годы активно
включают в различные схемы ТIVА и ВА. Установлено, что
минимальная доза при в/в введении, обеспечивающая аналгетический эффект, равна
0,5 мг/кг. Оптимальный аналгетический эффект без побочных явлений наступает
при введении 1 мг/кг (или 2 мг/кг/ч инфузионно); повышение дозы усиливает
только гипнотический эффект. Длительность действия кетамина дозазависима: при
введении 0,5 мг/кг — 2 мин; 1,0 мг/кг — 6 мин; 2,0 мг/кг — 10—15 мин.
Соматическую болевую чувствительность снижает сильнее, чем висцеральную. Кетамин
является корректором вегетативных (вагусных) проявлений опиатов, в также пропофола (дипривана).
В.М. Мизиков с соавт. (1994) стабилизируют индукцию пропофолом, вводя 0,5
мг/кг кетамина. Кетамином дополняют общую анестезию у пациентов с низким исходным
АД и (с осторожностью) — при выраженной гиповолемии, а также при низком
насыщении крови кислородом, требующем выключения закиси азота.
При использовании в
клинических дозах требуется профилактика побочных явлений, а при их развитии —
применение корректоров. Подробно описанные в литературе побочные явления
(повышение двигательной активности при индукции анестезии и в период выхода из
наркоза, галлюцинации, повышение АД, тризм жевательной мускулатуры)
корригируются введением диазепама.
Появились работы (Н.А. Adams,
1996) о новом препарате — производном кетамина — S(+)-Kemаминe.
Исследование на добровольцах (1 мг/кг в/в) показало, что препарат мало
отличается от кетамина (2 мг/кг): увеличивается плазменная концентрация
адреналина и норадреналина, АКТГ и кортизола, повышается среднее АД и ЧСС.
Пробуждение после введения S(+)-кетамина оказалось более
быстрым; остальные клинические показатели сравнимы с таковыми при
использовании кетамина.
Альтезин (СТ1341, альфатезин),
стероидный гипнотик, обладающий слабым аналгетическим действием. Синтезирован в
1971 г. (Великобритания). Препарат короткого действия с восстановлением
сознания через 10—15 мин после введения. Применяется в дозах 0,05—0,075 мл/кг
(дозы даются в мл из-за неоднородного состава препарата). Обеспечивает
выраженное снижение мышечного тонуса; незначительно снижает АД, увеличивая ЧСС.
В дозе 0,1 мл/кг и выше создает кратковременную дыхательную депрессию; при
пробуждении могут возникнуть миоклония и повышенная саливация. Один из
недостатков — растворитель препарата кремофор EL. Возможно, что малое число
публикаций о применении альтезина в последние годы связано с тем, что к
веществам, растворителем которых является кремофор (пропанидид, в частности),
стали относиться отрицательно из-за непредсказуемости серьезных побочных
явлений и грозных осложнений (анафилактический шок).
Сообщено (C.F. MacLeon et al., 1996) о новом стероидном
анестетике — эльтанолоне (eitanolon, coreltan) — на основе эмульсии.
Препарат с удовлетворительными фармакокинетическими свойствами. При двухчасовом
введении эмульсии в дозах 2 и 3,5 мг/кг/ч показатели следующие: клиренс —
соответственно 1,39 и 1,21 л/кг; t1/2а — 0,025 и 0,028 ч; t1/2В — 0,66— 0,65 ч; t1/2Y —
5,16—4,38 ч. Препарат вызывал умеренное снижение АД, отмечена хорошая
управляемость анестезии, непроизвольные движения не отмечены; пробуждение
дозазависимо (A. Wessen et al., 1996).
Данные Н.
Oven et al. (1996)
свидетельствуют в пользу появления непроизвольных движений под влиянием
эльтанолона, снижающиеся под влиянием морфина. Последний увеличивает риск апноэ
после введения эльтанолона.
Этомидат (гипномидат, раденаркон)
синтезирован в 1965 г. (Бельгия). Применяется для инцукции (0,2—0,3 мг/кг
одномоментно или 0,16 мг/кг/ч инфузионно) и как компонент TIVA
(гипнотическое состояние поддерживается капельной инфузией этомидата со
скоростью 0,005 мг/кг/мин). Это короткодействующий препарат с быстрой
индукцией (максимальная концентрация в крови создается через 1 мин после
введения) и пробуждением через 4—8 мин с быстрым восстановлением сознания,
адекватной ориентацией в месте и времени без неприятных воспоминаний о периоде
наркоза и галлюцинаций (хотя и описаны случаи постнаркозной дисфории).
Длительность сна зависит от дозы: при введении 0,2 мг/кг сон длится 2—3 мин,
0,3 мг/кг — 4—5 мин. Наблюдение за пациентом, перенесшим наркоз этомвдатом в
амбулаторных условиях, не менее 1 ч.
Препарат оказывает
минимальное воздействие на дыхание и ЧСС; обладает противоэпилептическим
эффектом; не освобождает гистамин, совместим с другими препаратами. Этомидат
не предупреждает постингубационную гипертензию; во многих применяемых схемах
TIVA перед введением этомидата вводят дроперидол с фентанилом.
Побочные эффекты: преходящее
снижение уровня кортико-стероидов (без снижения активности АКТГ); появление
непроизвольных движений; боль, жжение в месте инъекции (без явлений флебита);
после анестезии возможны кашель, рвота, гипертензия, брадикардия.
Препараты-корректоры позволяют нивелировать некоторые побочные эффекты
зтомидата.
Так, для профилактики
миоклонии в премедикацию целесообразно включить диазепам (можно использовать
дроперидол с фентанилом); с целью предупреждения повышения вагусной активности показана
дополнительная атропинизация. Серьезное практическое предупреждение: не
использовать для пункции тонкие вены!
Накоплен опыт использования
этомидата при поддержании общей анестезии (0,1—0,15 мг фракционно в/в через 10
мин) в комбинации с фентанилом при спонтанной вентиляции. Применение этомидата
в виде капельной инфузии при длительных и травматичных операциях (в комбинации
с высокими дозами опиатов) вызвало определенньш интерес анестезиологов в связи
с высокой антистрессорной защитой анестезии. Однако антистрессорную активность
можно объяснить снижением функции коры надпочечеников под влиянием этомидата.
С другой стороны, отмечено, что при постоянной инфузии этомидата имеет место
снижение печеночного артериального кровотока (возможно, за счет дозазависимого
снижения СВ и среднего АД). Сочетание этих побочных явлений способно увеличить
анестезиологический риск у пациентов при длительной инфузии этомидата.
Видимо, с этим связано значительное уменьшение числа публикаций в последние
годы о применении этомидата в целях поддержания общей анестезии.
Пропофол (диприван) синтезирован в
1976 г. (Великобритания); в России применяется с 1993 г. Это препарат
(2,6-диазопропиленфенол) в виде водно-масляной эмульсии. Липофильность
препарата обеспечивает быстрое проникновение в ЦНС (выключение сознания —
через 30—40 сек от начала введения, «на кончике иглы»). Быстро выводится из
организма, не обладает способностью к кумуляции, метаболизирует в печени.
Вызывает местное раздражение, не вызывая некроза (перед введением
целесообразно ввести лидокаин в небольшой дозе). Умеренный миорелаксирующий
эффект пропофола в сочетании с подавлением рефлексов с гортаноглотки делает
удобным применение ларингеальной маски.
Пропофол снижает повышенный
мышечный тонус и судорожную готовность (что используется в неврологии и психиатрии).
Правильное введение пропофола (титрование по 40 мг каждые 10 сек) предупреждает
развитие апноэ. Общая индукционная доза 2,0—2,5 мг/кг.
Умеренная гипотония,
развитие которой возможно при введении пропофола, обусловлена снижением общего
сосудистого сопротивления, особенно у пожилых.
Имеются экспериментальные
данные о возможности блокады кальциевых каналов пропофолом и снижения за счет
этого высвобождения норадреналина (N. Rolf, 1996, N.L. Biddle et al., 1996). Снижение ЧСС
(ваготонический эффект пропофола) предупреждается и корригируется введением
холинолитиков (атропин, метацин).
Отсутствие кумулятивного
эффекта позволяет применять пропофол (диприван) для поддержания анестезии любой
продолжительности. С целью инфузионного введения Пропофол растворяют в 5%-ном
растворе глюкозы и переливают из поливенилхлоридных или стеклянных емкостей.
Поддержание возможно и при фракционном введении (болюсы по 50— 25 мг, по мере
необходимости).
Зарубежные данные
свидетельствуют о широком диапазоне доз пропофола при инфузионном введении — от
4 до 12 мг/кг/ч. Это зависит от многих факторов, включая возраст больных,
эффект премедикации, характер вмешательств и потенцирующее влияние других
препаратов. Так, расход пропофола снижается при комбинации с фентанилом и
суфентанилом; последний, по данным бельгийских авторов (М.Н. Lauvers et al., 1996), проявляет
отчетливый синергизм с пропофолом. Было показано, что с возрастом доза
пропофола снижалась с 10 мг/кг/ч у молодых пациентов до 8,6 мг/кг/ч у больных
старше 65 лет. Влияние интенсивности хирургической агрессии на инфузионную
дозу пропофола было доказано на основании различий в концентрациях препарата в
плазме при операциях на поверхности тела — 2,97 мг/мл и при абдоминальных
вмешательствах — 4,04 мг/мл.
Пропофол (диприван) применяют
при кратковременных манипуляциях и оперативных вмешательствах в хирургии «одного
дня», при лапароскопических операциях, в сердечно-сосудистой, абдоминальной и
торакальной хирургии. В работах отечественных авторов (А.А. Бунятян с соавт.,
Б.Р. Гельфанд с соавт., С.Ф. Грицук, Г.Г. Жданов, В.Д. Малышев, В.М. Мизиков,
Ю.С. Полушин и др.) отражен значительный опыт применения дипривана при
различных оперативных вмешательствах. При лапароскопических операциях (В.В.
Лихванцев, 1995) индукции анестезии достигают введением дипривана (1,93+0,02
мг/кг) и фентанила (4,34+0,26 мкг/кг); поддерживают анестезию
диприваном инфузионно (6 мг/кг/час), фентанилом и N2O (65%).
Отмечают хорошую управляемость и достаточную глубину анестезии с быстрым и
полным пробуждением, последующим хорошим самочувствием пациентов. И.А. Козлов
с соавт. (1995) использовали диприван при малых операциях (имплантации
постоянных ЭКС), операциях на сердце без ИК и с ИК, поддерживая анестезию
диприваном инфузионно со скоростью 6 мг/кг/час. Н.А. Осипова с соавт. (1996)
включает диприван в различные схемы TIVA и ВА при различных
вмешательствах в онкологии — от мастэктомии и лимфаденэктомии до полостных
операций на желудке и пищеводе.
В схеме ВА (калипсол,
фентанил, N2O, миорелаксанты, ИВЛ) инфузию
дипривана осуществляют со скоростью 2,1 мг/кг/ч.
Зарубежные данные
свидетельствуют о хороших результатах применения пропофола при
нейрохирургических вмешательствах (в комбинации с альфентанилом или
суфентанилом) — отмечено снижение церебрального метаболизма, отсутствовали эпизоды
пшертензии. Поддержание анестезии осуществляется инфузией пропофола при
начальной скорости 150—200 мкг/кг/мин с последующим снижением до 100—120 мкг/кг
мин.
Позитивные результаты
получены при больших торакальных операциях (T.J. Trinder et al., 1996); при сравнении с методикой ВА
<сгиопентон/изофлюран» применение комбинации «пропофол/альфентанил» дало
удовлетворительные результаты (величина SpO2 в динамике была выше при
TIVA). При операциях в кардиоторакальной хирургии (Gao Tean Hua et al., 1996)
анестезию поддерживают пропофолом (1,72—4,96 мг/кг/ч) и фентанилом с
удовлетворительными результатами. Схожесть гемодинамических профилей при
использовании методик анестезии, включающих пропофол или изофлюран, отмечена
при операциях ортотопической трансплантации печени (Мога А., 1994; Roige J. et al., 1994).
Американскими специалистами (N.R. Fahmy et al., 1996) установлено, что при
длительной инфузии пропофола (0,11+0,003 мг/кг/мин) адренокортикальная функция
не подавлена.
В субнаркотических дозах пропофол
(диприван) вызывает антиэметический эффект и с успехом используется для профилактики
и лечения послеоперационной тошноты и рвоты — синдрома PONV (post operative nausea and vomiting). В
сравнительных исследованиях пропофол оказался активнее изофлюрана в
профилактике PONV (C.D. Brooker et al., 1996).
Постепенно утверждается
мнение, что пропофол (диприван) по степени анестезиологической защиты,
управляемости и возможности точной дозировки с помощью постоянно совершенствующейся
техники становится альтернативой ингаляционным анестетикам — изофлюрану,
севофлюрану и дезфлюрану; с последним пропофол сопоставим по времени
пробуждения пациентов и опережает изофлюран.
Бензодиазепины
Производные бензодиазепина
(БЗД) по клиническому эффекту относятся к транквилизаторам (tranquilloare,
лат. — успокаивать), хотя в более высоких дозах вызывают гипнотический
эффект; БЗД активно воздействуют на ГАМК-ергические рецепторы, потенцируя
центральное ингибирующее действие у-аминомасляной кислоты. В клетках ЦНС
обнаружены специфические «бензодиазепиновые» рецепторы, для которых БЗД являются
лигандами.
Специфические БЗД-рецепторы
в ЦНС описаны в 1977 г.; вместе с рецепторами ГАМК они образуют единый протеиновый
ГАМК-БЗД-СL-канальный комплекс.
Рецепторы представлены во многих
органах, включая миокард. БЗД способствуют высвобождению ГАМК и ее влиянию на
синаптическую передачу. Нейрофизиологами установлено, что БЗД (в частности,
диазепам) подавляют вызванные потенциалы в ответ на электрические и звуковые
раздражители в образованиях таламуса и лимбической системы. Имеются данные,
что диазепам является антагонистом химических медиаторов в ЦНС (ацетилхолина,
серотонина, катехоламинов). Широко применяются для снижения тревоги, при
депрессии, истерии, возбуждении, агрессивности и других реактивных состояниях
психики; снижает эпилептиформную активность, базальный тонус
поперечно-полосатой мускулатуры (за счет угнетения нейронов спинного мозга и
полисинаптических проводящих путей супраспи-нальных структур). Первьм
бензодиазепином (БЗД), синтезированный в 1956 г., был хлордиазепоксид
(либриум), который и в наши дни с успехом применяется как пероральный
анксиолитик.
Диазепам (валиум, седуксен, сибазон,
реланиум) синтезирован Stembach, Reeder в 1960 г. Как средство
медикаментозной подготовки применен впервые во Франции в 1964 г. При приеме
внутрь диазепам быстро всасывается из ЖКТ; максимальная концентрация в плазме
достигается через 2—4 ч. Выводится в два этапа: первый этап — быстрый, с
периодом полувыведения 10 ч (в крови содержится только диазепам), второй —
медленный, с периодом полувыведения 2—3 дня (в крови содержится метаболит —
а-диметилированный аналог диазепама). При в/в введении время полувьшедения
диазепама —30 ч, его метаболита— 100 ч.
Диазепам незначительно
влияет на АД и ЧСС. Мнения исследователей в отношении влияния диазепама на
дыхание расходятся.
Рекомендуют различные дозы
диазепама для индукции — от 0,2 до 0,6 мг/кг, обеспечивающие наступление
гипнотического эффекта с последующей ретроградной амнезией. При быстром
введении возможно умеренное снижение АД, возвращающееся к исходному уровню
через 5—7 мин. Диазепам, включенный в индукцию, предупреждает мышечные
фибрипляции и последующие боли в связи с введением сукцинилхолина. Как средство
для индукции, а также компонент сбалансированной анестезии, диазепам нашел
применение в офтальмологической практике (снижение внутриглазного давления),
нейрохирургической и ЛОР-практике (возможность операции в положении сидя),
акушерстве (отсутствие влияния на сократимость матки и новорожденного), в
амбулаторной стоматологии, при кардиоверсии, различных эндоскопических и
кардиологических исследованиях. Как препарат-корректор, диазепам нивелирует
побочные эффекты опиатов (снижает частоту тошноты и рвоты), одновременно снижая
их расход. Хорошо известны свойства диазепама как корректора побочных эффектов
кетамина.
Противопоказания: миастения, первый триместр
беременности (в современных аннотациях указывается на осторожность
применения), острые заболевания печени и почек. Не следует сочетать с
ингибиторами МАО. Алкоголь потенцирует действие диазепама.
Мидазолам (дормикум, флормидал) в
клиническую практику введен в начале 80-годов (Великобритания, 1982). Это
первый водорастворимый БЗД, имеющий наиболее короткую продолжительность действия.
Время полураспределения — 25—30 мин, время полувыведения мидазолама — 1,5—3,0
ч, его метаболитов — <1,5 ч. Мидазолам широко применяется для премедикации
(0,05—0,1 мг/кг) и индукции (0,15— 0,2 мг/кг) с аналгетиками. Среднее время
наступления гипнотического эффекта составляет немного более 60 сек. Для индукции мидазолам
применяют в дозе 0,15—0,2 мг/кг. Мидазолам применяется и в комбинации с
пропофолом, главным образом для снижения его дозы. Пробуждение после введения
мидазолама быстрое, в этом он даже конкурирует с пропофолом (диприваном).
Японские исследователи (Т. Nishijama et al., 1994) показали, что при использовании мидазолама в
ответ на интубацию повышения в плазме уровня адреналина и норадреналина не
происходит. По данным В.А. Гологорского с соавт. (1994), доза мидазолама 15 мг
не влияет на сердечно-сосудистую систему. Шведские анестезиологи (Р. Grattidge,
U. Caplsson, 1994) используют малые (субгипнотические) дозы
мидазолама (0,06 мг/кг) при гастроскопии. Его широко применяют при
выскабливании полости матки (0,07 мг/кг) с фентанилом (3 мкг/кг) при спонтанном
дыхании пациенток.
Флюнитрозепам (рогипнол). Применяется для
премедикации (0,015—0,03 мг/кг) и индукции. В дозе 2 мг (1мл) в/в вызывает
быстрое наступление гипнотического эффекта; оптимальная скорость введения для
индукции 1 мг/30 сек. Для поддержания анестезии вводят дробно малые дозы
препарата. Для в/в введения требуются вены большого калибра; при введении в
артерию возможен некроз. Как и другие БЗД, препарат потенцирует действие нейролептиков,
аналгетиков, анестетиков и других средств, угнетающих ЦНС. Как и другие БЗД,
флюнитрозепам оказывает анксиолитическое, миорелаксирующее и противосудорожное
действие. Связывается с белками плазмы (80%), проникает через плацентарный
барьер, выделяется с грудным молоком. Побочные эффекты проявляются в виде
незначительного снижения АД, угнетения дыхания, особенно у пожилых.
Противопоказания: абсолютное — miastenia gravis, относительные — первый триместр беременности,
лактация. Потенцирует действие миорелаксантов, усиливает угнетающее действие
на ЦНС нейролептиков, транквилизаторов и седативных средств. В зарубежной
литературе последних лет флюнитрозепам упоминается намного реже мидазолама —
препарата, постепенно вытесняющего из схем ВА и TTVA другие бензодиазепиновые
производные.
Антагонисты бензодиазепиновых
рецепторов. Флумазенил (анексат) — первый специфический антагонист БЗД, синтезированный
в 1979 г. и введенный в клиническую практику в начале 80-х годов. Выпускается в виде
водного раствора в ампулах (500 мкг в 5мл или 1 мг в 10 мл). Быстро купирует
все эффекты БЗД включая амнезию, депрессию дыхания, не приводя к гипертензии
(по аналогии с налоксоном). Продолжительность действия при в/в введении
зависит от дозы и колеблется от 15 до 140 мин (средняя продолжительность —
около 60 мин).
Средняя эффективная доза — 1
мг (рекомендуют начинать с первой дозы 0,2 мг, титруя эффект введением по 0,1
мг с небольшими перерывами). Следует учитывать возврат к так называемой
резидуальной седации, которая может произойти при высокой суммарной дозе БЗД,
особенно у пожилых больных.
Из многочисленных
литературных данных хорошо известно, что антагонистами бензодиазепинов
являются и антихолинестеразные препараты (прозерин, физостинмин), что следует
учитывать в практике.
АНАЛГЕТИКИ
Рецепторы
опиоидов
По современным
представлениям, фармакологические эффекты, вызываемые наркотическим
аналгетиками, обусловлены взаимодействием со специфическими местами связывания
мембран клеток — рецепторами. Первоначально выделялись три типа опиоидных
рецепторов: мю-,сигма- и к-, названные так по начальным буквам
прототипов их агонистов: морфина, SKF-1047 и кетоциклозацина.
Локализация и возможная роль опиатных рецепторов и их агонистов суммированы в
табл. 11.1 и 11.2.
В дальнейшем в ЦНС были
обнаружены также эпсилон-, дельта- и лямда- рецепторы. Однако
возникли некоторые сомнения относительно В-рецепторов, которые сейчас
ряд авторов предлагают выделить в отдельную сигмаергическую систему.
По мнению Chang
К., Cuatrecacsas (1981), в головном мозге имеются три различные
области, характеризующиеся локализацией тех или иных рецепторов опиатов:
1. Отделы мозга, в которых
превалируют мю-рецепторы, гипоталамус и таламус.
2. Отделы мозга, в которых
имеет место выраженное превалирование мю-рецепторов над дельта-рецепторами,
— ствол, гиппокамп, лимбическая система.
Локализация и функция
опиоидных рецепторов в ЦНС
|
Спинной
мозг |
Спинальная аналгезия |
|
Околоводопроводное
вещество |
Супраспинальная
аиалгезия |
|
N.n. solitarius, commissuralis, ambiguus |
Регуляция
висцеральных рефлексов (депрессия дыхания, ортостатическая гипотония) |
|
Медиальное
и латеральное оптические ядра |
Миоз |
|
Лимбическая
система |
Эйфория |
|
Базальное
ядро |
Регуляция
двигательного поведения |
|
Locus cerulius |
Эйфория |
|
Megial eminence |
Регуляция нейроэндокринных функций |
Фармакологические эффекты
агонистов мю-, к- и сигма- опиоидных рецепторов
|
Действие на |
мю- |
К |
сигма |
|
зрачок |
Миоз |
Миоз |
Мидриаз |
|
ЧД |
Стимуляция, затем депрессия |
Нет изменений |
Стимуляция |
|
ЧСС |
Брадикардия |
Нет изменений |
Тахикардия |
|
температуру тела |
Гипотермия |
Нет |
Нет |
|
аффект |
Безразличие к различным стимулам |
Седация |
Делирий |
|
кожную чувствительность (супраспиналь-ные
рефлексы) |
Снижение |
Нет |
Нет |
|
ноцицептивные рефлексы (спинальные) |
Снижение |
Повышение |
Некоторое снижение |
3. Отделы головного мозга, в
которых имеется примерно одинаковое число мю- и дельта-рецепторов,
— кора мозга, полосатое тело.
К-рецепторы распределены подобно ц-рецепторам, но их абсолютное число в 2—3 раза меньше.
Эндогенные лиганды опиоидных рецепторов
В настоящее время выделено и
идентифицировано свыше 20 эндогенных лигандов опиоидных рецепторов.
Установлено, что в организме человека и животных опиоидные пептвды первоначально
формируются в виде высокомолекулярного предшественника. Образование собственно
нейропептидов происходит в ходе ферментативной фрагментации последнего.
Процессинг опиоидных пептвдов протекает в эндоплазматическом ретикулуме, где
молекула предшественника продвигается к секреторным гранулам, и под
воздействием протеолитических ферментов, в частности трипсиноподобных протеаз,
осуществляется фрагментация полипептидной цепи на функционально активные
молекулы.
Все опиоидные пептиды в
зависимости от белка предшественника можно разделить на три группы,
происходящие из:
— проопиомеланокортина:
основной представитель — В-эндорфин;
— проэнкефалина А,
содержащего в своем составе мет- и лей-энкефалины;
— проэнкефалина В,
содержащего динорфин, а-нео-эндорфин и лейморфин.
Фармакология опиатов
Основной эффект, присущий
препаратам указанной группы, — аналгезия. Принято считать, что чем выше
сродство препарата к т-опиоидным рецепторам, тем более выражены у него
свойства аналгетика. В этой связи наркотические аналгетики, в комбинации с
другими препаратами, используются в большинстве схем вводного наркоза и
поддержания анестезии. В больших дозах наркотические аналгетики могут использоваться
как основное вещество для поддержания анестезии (например, в
кардиоанестезиологии, так называемая центральная аналгезия).
Механизм действия наркотических
аналгетиков связан со специфическим взаимодействием с опиоидньши рецепторами
ЦНС и спинного мозга.
Опиаты
Известные побочные эффекты
фентанила побудили поиск новых опиатных аналгетиков. Были синтезированы новые
препараты (альфентанил, суфентанил, ремифентанил), получившие большое
распространение в современных схемах ВА и TTVA. Инфузионный метод введения
аналгетиков более эффективен за счет создания постоянной концентрации препарата
в крови и экономичен.
Суфентанил — синтетический опиоид, в
5—10 раз мощнее фентанила; терапевтический индекс в 100 раз больше. Период
полураспределения — 0,72 мин, период полураспада — 13,7 мин. Почти полностью
связывается с белками (92,5%), липофилен. Обладает более быстрым, по сравнению
с фентанилом, началом действия. В дозах 10—20 мкг/кг создает надежную
ангигипертензивную защиту. Снижает MAC ингаляционных анестетиков
более значительно, чем фентанил. Не освобождает гистамин.
У суфентанила (так же как и
фентанила) печеночный клиренс превышает печеночный кровоток; при снижении
последнего вследствие системной артериальной гипотонии, сердечной
недостаточности и заболеваниях печени элиминация альфентанила задерживается.
Почки косвенно влияют на элиминацию суфентанила и других опиатов, замедляя ее
при заболеваниях за счет нарушения распределения интра- и экстрацеллюлярной
жидкости.
Суфентанилу присуще
гипноседативное действие; его синергизм по отношению к пропофолу (дипривану)
был зарегистрирован S. Schraag et al. (1996) при сравнении суфентанила и альфентанила
(в эквипотенциальных дозировках) в отношении индукционной дозы пропофола,
который вводили методом титрования до получения эффекта (волны на ЭЭГ с
частотой 10 Гц); расход пропофола оказался ниже на фоне действия суфентанила
более чем в 2 раза. В исследовании М.Н. Lauwers et al. (1996) при увеличении дозы суфентанила (с 15 до
45 мкг) время потери сознания под влиянием пропофола достоверно снизилось.
Хорошие результаты
применения суфентанила получены в нейроанестезиологии. При краниотомии по
поводу опухолей расход пропофола оказался ниже при использовании суфентанила
(0,4 мкг/кг/ч) по сравнению с применением фентанила и альфентанида (Р. Kessler et al., 1996). Суфентанил показал
хорошие результаты у кардиохирургических больных с низкой фракцией выброса
(менее 40%) как после интубации трахеи, так и после стернотомии (J.C. D. Pereira et al., 1996); лучше фентанила
блокирует ноцицептивные импульсы (O.H.G. Wider-Smith, 1996).
Альфентанил — синтетический опиоид; в 4
раза слабее фентанила, но обладает более быстрьм началом действия и короткой
продолжительностью. Клиренс альфентанила снижается, а элиминация удлиняется у
больных, получавших эритромицин (R R Barkowski et al., 1990).
Альфентанил успешно
применяется при кратковременных операциях. Наиболее удачно сочетание альфентанила
с пропофолом (диприваном). В эксперименте показано, что средние дозы не
вызывают изменений центральной гемодинамики, в то время как большие (5 мг/кг)
приводят к увеличению ЧСС и СВ.
При нейрохирургических
операциях применение альфентанила для индукции (10—20 мкг/кг) и поддержания
анестезии (инфузионно, начиная со скорости 1,5—2 мкг/кг/мин и снижая до 0,3
мкг/кг/мин) на фоне пропофола показало снижение церебрального метаболизма,
отсутствие эпизодов гипертензии (В. van Aken,
1996). N. Baykan et al. (1994) применяют комбинацию альфентанила (0,03
мг/кг/ч) с пропофолом при краниотомии с хорошим эффектом.
Замечательный результат
получили R.G. Aquado et al., (1994) при тимэктомии у больных с miasthenia gravis: использовали инфузию альфентанила (1,5 мг/кг/мин)
в комбинации с пропофолом («ступенчатая» инфузия от 167 до 50 мкг/кг/мин) без
миорелаксантов.
Специальные исследования (A.L. Lindekaer et al., 1994) показали, что
сочетание альфентанила с пропофолом (диприваном) в амбулаторной практике не
оказывает существенного влияния на психомоторные функции.
Ремифентанил — первый в этом классе опиоид
с очень коротким временем полужизни (менее 10 мин) за счет высокой степени
эстеразной активности метаболизма, что обусловливает быстрое прекращение
действия. Сравнение ремифентанила с альфентанилом в амбулаторной практике (Е Chung,
1996) при инфузионном введении в комбинации с пропофолом показало лучшую
гемодинамическую стабильность при использовании ремифентанила в дозе 0,5
мкг/кг/мин. F. Cama et al. (1996) сравнивали аналгетические эффекты
ремифентанила и фентанила при больших абдоминальных операциях. В дозе 0,4
мкг/кг/мин ремифентанил оказался эффективнее фентанила; побочные реакции не
выявлены. R.J.R. Duthie et al. (1996) вводили ремифентанил
инфузионно в дозах от 1,0 до 2,0 мкг/кг/мин с пропофолом при операциях
аорто-коронарного шунтирования и в послеоперационный период. Этим же опытом
обладает F. Geisler (1996), вводивший
ремифентанил с пропофолом по аналогичной методике. Минимальный гипертензивный
ответ бьш зафиксирован только во время стернотомии. Авторы считают, что
ремифентанил создает глубокую аналгезию, блокирующую ноцицепгивные импульсы,
без побочных эффектов.
Опыт клиницистов выделяет
очевидные преимущества опиатов, включаемых в схемы ВА и TIVA,
особенно на этапе индукции: снижается доза гипнотика, нивелируется реакция сердечно-сосудистой
системы на ларингоскопию и интубацию трахеи; последнее очень важно у
нейрохирургических больных (профилактика повышения внутричерепного давления) и
у пациентов с сопутствующей патологией (гипертоническая болезнь, ИБС).
Некоторые препараты с мю-агонистической активностью имеют в настоящее время менее широкое применение в схемах ВА и TIVA.
Пиритрамид (дипидолор), агонист мю-рецепторов;
по аналгетической активности 15 мг дипидолора эквивалентны 10— 20 мг морфина.
При операциях аналгезия удовлетворительного уровня достигается введением 0,075
мг/кг препарата. Для поддержания достаточно введения 3—5 мг/ч. Преимущества по
сравнению с морфином: в меньшей степени вызывает депрессию дыхания, тошноту и
рвоту, имеет высокий терапевтический индекс, не вызывает привыкания.
Применялся довольно широко в
80-х годах в составе сбалансированной анестезии (А.А. Бунятян с соавт.,1984) в
комбинации с диазепамом (седуксеном). Для индукции вводили седуксен (10—15 мг
в/в) и дипидолор (15 мг в/в); поддержание анестезии осуществляли дробным
введением дипидолора по 5— 7,5 мг через 30—60 мин и седуксеном (повторно через
60 мин).
Трамадол гидрохлорид (трамал).
Считается частичным мю-агонистом опиатных рецепторов, но обладает
двойным (опиоидзависимым и опиоиднезависимым) действием. В эксперименте
установлено, что налоксон ингибирует аналгезию трамадолом только частично.
Аналгезию снижают также антагонисты серотониновых рецепторов; не исключено воздействие
препарата на а2-адренергические рецепторы, с которыми
взаимодействуют опиоиды.
Видимо, в связи с низким сродством к т-рецепторам трамадол считают
аналгетиком средней силы действия, которая составляет около 1/3—1/5
аналгетического потенциала морфина и эквивалентна потенциалу пентазоцина.
Эффект 1 мг/кг трамадола сравним с таковым у бупренорфина в дозе 3 мкг/кг,
налбуфина (1 мг/кг), морфина (1 мкг/кг). Проявив высокие качества в лечении
острого и хронического болевого синдрома, трамадол вместе с тем не нашел
широкого применения как эффективный аналгетик в составе многокомпонентной
анестезии при оперативных вмешательствах.
Опиоиды (агонисты-антагонисты)
Большинство известных
агонистов-антагонистов (пентазоцин, налбуфин, буторфанол) как агонисты к-рецепторов
вызывают опиоидзависимые эффекты (аналгезия и седация). Взаимодействуя с мю-рецепторами,
эти препараты создают антагонистические эффекты (например, в отношении
опиатной депрессии дыхания, хотя в больших дозах сами могут ее вызывать).
Пентазоцин (лексир, фортрал).
Агонист-антагонист опиатных рецепторов. При в/в введении характеризуется
коротким периодом распределения. Применяется с 80-х годов (А.А. Бунятян с
соавт, 1984) как компонент сбалансированной анестезии. В литературе имеются
данные об умеренном гипердинамическом эффекте пентазоцина при в/в введении 30
мг (увеличение АД и ЧСС), что связывают с активацией а-адренорецепторов,
которая подавляется дроперидолом. Это опровергается данными других авторов,
свидетельствующими, напротив, о вазоплегическом влиянии препарата. В дискуссиях
на эту тему не исключалось влияние других факторов, связанных с наркозом,
операцией и переохлаждением пациентов. Введение пентазоцина в дозе 1—2 мг/кг
больным в сознании, по данным фотоплетизмографии, выявило расширение сосудов
кожи пальцев. Введение пентазоцина как антагониста морфина (фентанила) осуществляется
за 10—15 мин до окончания операции: в/в медленно (в течение 2—3 мин) вводят
пентазоцин (1 мг/кг); целесообразно вначале ввести половину расчетной дозы, а
через 3—4 мин — оставшуюся часть. Эффект пробуждения и восстановления самостоятельного
дыхания наступает через 3—4 мин. Уменьшая депрессию дыхания, связанную с
применением фентанила, пентазоцин при в/в введении сам приводит к ней, хотя
длительность депрессии значительно меньше.
Налбуфин (нубаин). Агонист
к-рецепторов и антагонист мю-рецепторов (период полувыведения — 3,5 ч).
Широко используется для лечения острой и хронической боли. Имеет высокий
терапевтический индекс, не обладает кардиодепрессивным действием,
гипертензивной активностью, не освобождает гистамин. Налбуфин включают в
премедикацию (0,1 мг/кг в/м) и дополняют общую анестезию. Описаны схемы
анестезии с введением основной дозы налбуфина (0,15—0,25 мг/кг) и поддерживающих
(0,05—0,075 мг/кг). Применение налбуфина предупреждает послеоперационную
тошноту и рвоту. Налбуфин как агонист к-рецепторов имеет меньшую
анальгетическую активность по сравнению с опиатными аналгетиками. В схемах TTVA и ВА
его применяют в комбинации с препаратами-потенциаторами аналгетической и
нейровегетативной активности, в частносги с клонидином (клофелином). Последний
назначают дополнительно в дозе 25—50 мкг в/в. Налбуфин вызывает депрессию
дыхания, если при в/в введении его доза составляет более 20—30 мг/70 кг. Как
антагонист мю-рецепторов, налбуфин применяется для предупреждения
инверсии дыхательной депрессии, вызванной опиатами, в частности фентанилом.
Эффективной дозой считается 20 мг, однако, по другим данным. достаточно ввести
0,1 мг/кг для нормализации EtCO2.
Буторфанол тартрат (морадол, стадол, бефорал),
частичный агонист к-рецепторов и антагонист мю-рецепторов. Обладает
выраженным аналгетическим действием (2 мг в/м или 1 мг в/в), позволяющим
купировать острую послеоперационную боль и болевые приступы при печеночной и
почечной коликах. За счет отчетливого седативного действия применяется в
премедикации. В литературе имеются многочисленные ссылки на попытку применения
буторфа-нола (БТ) в схемах ВА и TIVA, однако в целом эффект не
убедителен (даже при применении сравнительно больших доз БТ — 4—6 мг
в/в), так как препарат применялся либо на фоне кетамина, либо в комбинации с
большими дозами диазепама или клонидина. Включение диазепама оправданно только
при длительных операциях и требует, как правило, применения ИВЛ в течение
нескольких часов послеоперационного периода. Так же как и налбуфин, БТ
обладает возможностью инверсии «фентаниловой» депрессии дыхания; с этой целью
вводят 1 мг БТ. Эффект, как правило, наступает через 1,5—2 мин и
характеризуется увеличением МОД и ЧД, понижением EtCO2; при недостаточном эффекте
можно дополнительно ввести 1 мг БТ.
Следует отметить, что
современная литература, уделяющая много внимания опиатам нового поколения
(алъ-фентанил, суфентанил, ремифентанил), все реже посвящается применению
частичных агонистов-антагонистов в схемах сбалансированной (ВА) и тотальной
внутривенной анестезии (TIVA). Видимо, гарантированный
аналгетический эффект при оперативных вмешательствах можно получить только при
использовании мю-агонистов.
Побочные эффекты опиоидов. Все опиоидные агонисты мю-рецепторов
вызывают дозозависимое угнетение дыхания, что обусловлено снижением
чувствительности ДЦ ствола мозга к СО2. Опиоиды медленно выводятся
из организма; после окончания в/в инфузии риск дыхательной депрессии может сохраняться
несколько часов. Метаболит морфина (морфин-6-глюкуронид) особенно агрессивен в
отношении дыхательной депрессии, превосходя сам морфин. Метаболиты фентанила,
суфентанила и альфентанила подобные эффекты не создают. Селективные агонисты
к-рецепторов практически не влияют на дыхание.
Мышечная ригидность (мышцы
грудной клетки и живота) может возникнуть при введении опиоида в большой дозе.
Нередко она становится препятствием для спонтанной и искусственной
вентиляции; купируется введением миорелаксантов, ослабляется введением
барбитуратов и бензодиазепинов. Мышечную ригидность может усилить закись азота
и гипоксия.
В ЖКТ обнаружена высокая
концентрация опиатных рецепторов (общее эмбриональное происхождение ЖКТ и
ЦНС). Эффекты опиоидов на ЖКТ проявляются угнетением опорожнения желудка и
перистальтики.
Хорошо известно действие
опиоидов, затрудняющее механизм желчеотделения: повышение давления в общем
желчном протоке, снижение продукции и оттока желчи в связи со спазмом сфинктра
Одди, повышение тонуса общего желчного протока.
Тошнота и рвота возникают в
результате стимуляции опиоидами хеморецепторной триггерной зоны (ХТЗ). При
больших концентрациях опиоиды подавляют рвотный центр (рвота — редкое явление
в кардиохирургии), в малых дозах (но при повторном введении) — вызывают
стимуляцию ХТЗ.
Развитие артериальной
гипотензии определяется снижением общего периферического сосудистого
сопротивления (ОПСС) за счет освобождения гистамина под влиянием морфина и
петидина (промедола). Фентанил и новые опиаты (альфентанил, суфентанил) не
вызывают гистаминлиберацию. Кардиодепрессивное воздействие опиатов связывают
только с петидином (в больших дозах).
Налоксон (антагонист опиатных
рецепторов) обладает высоким сродством к рецептору, в силу чего способен
перемещать (вытеснять) любой лиганд, занимающий опиатсвязывающий участок
(конкурентный антагонизм). Поскольку налоксон не обладает внутренней
активностью, он не вызывает аналгезию. Используется для лечения опиатной
депрессии дыхания; при его применении устраняется антиноцицептивное действие
опиоидов: появляются гипертензия, тахикардия; возможны аритмии и даже отек
легких (при нормо- и гипокапнии эти проявления менее значительны). Действие
налоксона короче, чем опиоидов, поэтому возможен рецидив дыхательной депрессии.
Требуется соблюдение важного принципа — сохранение аналгезии. С этой целью
налоксон вводят по схеме (Е. Freye,1987):
Схема применения налоксона после анестезии опиоидами
(Е. Freye, 1990)
Начальная доза налоксона
0,04 мг в/в —> 1—2 мин наблюдения —>
ЧД менее 12/мин —>
повторно налоксон 0,04 мг —> 1—2 мин наблюдения —> если ЧД < 12/мин,
вводить далее по этому принципу —> если ЧД > 12/мин, перейти через 30—45
мин на в/м введение.
НЕЙРОВЕГЕТАТИВНАЯ ЗАЩИТА
Нейролепгики (бутирофеноны)
и транквилизаторы (бензодиазепины) обеспечивают одно из необходимых условий
сбалансированной анестезии — нейровегетативную защиту. Основной нейролептик
бутирофенонового ряда — дроперидол — получил исчерпывающую характеристику в
многочисленных работах за более чем тридцатилетнюю историю своего клинического
применения.
В разделе «Гипнотики» мы
осветили разные стороны действия бензодиазепинов, в том числе их
вегетостабилизирующее и потенцирующее действие. Нейропдегики (фенотиазины) в современной
анестезиологии (главным образом, зарубежной) не применяются; ганглиоблокаторы
используются только с целью обеспечения эффекта управляемой гипотонии или как
метод лечения артериальной гипертонии.
В последние годы в целях
усиления нейровегетативной защиты применяются адренопозитивные средства,
обладающие и аналгетическим эффектом. В связи с этим внимание ученых привлечено
к изучению механизмов боли на основе сопряжения опиоид-, адрено- и
серотонинергических механизмов регуляции болевой чувствительности.
Адренопозитивные средства. К ним относят а2-агонист
клонидин (клофелин) и его структурные аналоги (гуанфацин,
лофексидин, ксилозин), обладающие гипотензивньм, седативным и аналгетическим
действием. Гипотензивное действие связывают со снижением концентрации
катехоламинов за счет нарушения их высвобождения из депо.
Препарат вводят в составе
премедикации и при вводном наркозе (2,5—3,5 мкг/кг, пожилым дозу снижают до
2,0— 1,8 мкг/кг). Другие авторы рекомендуют введение не более 1,5 мкг/кг. В
дозе 1,25 мкг/кг клонидин применяют для профилактики постинтубационной
гипертензии (Е. Pizzirani et al.,
1994). Получены удовлетворительные результаты при использовании клонидина
(клофелина) в комбинации с бупренорфином, налбуфином, буторфанолом. Включение
клонидина в схемы анестезии создает антистрессорную устойчивость, что
выражается в стабильном уровне кортикостероидов в плазме крови. Важное
качество клонидина — профилактика тошноты и рвоты в постнаркозный период.
Клонидин не влияет на дыхание. В дозе 2 мкг/кг снижается центральное симпатическое
влияние на сердце, происходит угнетение желудочной секреции. Умеренное
снижение АД не сопровождается уменьшением СВ, функции почек; более того, было
отмечено увеличение диуреза на 25%. Видимо, из-за более активного воздействия
клонидина на а1-адренорецепторы (спинальные) его чаще
используют эпидурально, хотя развитие нежелательных эффектов (гипотония,
брадикардия) чаще имеет место именно при этом способе введения препарата.
Считая клонидин препаратом,
способным непредсказуемо и неуправляемо снижать АД и приводить у отдельных
пациентов к развитию синдрома слабости синусового узла, некоторые анестезиологи принципиально
отказываются от его применения в схемах комбинированной анестезии. Вместе с тем
идет поиск препаратов адренопозитивного ряда, лишенных указанных побочных
явлений. В частности, имеется опыт применения структурного аналога клонидина —
гуанфацина, липофильного препарата, имеющего большее сродство к а2-адренорецепторам. Пока нет
лекарственной формы гуанфацина для парентерального введения, и препарат
применяют per os в дозе 2 мг главным образом
для лечения болевого синдрома и острой боли в послеоперационный период.
Описаны результаты
исследования (Р. О. Taike et al.,
1996) нового а2-агониста
адренорецепторов — дексмедетомидина (dexmedetomidin) — первого анестетика,
работающего на специфических рецепторах. Авторы с положительной стороны характеризуют
дексмедетомидин (ДМТ) как препарат с высокой седативной и аналгетической
активностью, стабилизирующей гемодинамику; ДМТ уменьшает гипертензию и
тахикардию у пациентов с кардиоваскулярной патологией как во время операции,
так и в ближайший послеоперационный период; препарат показал потенцирующие
свойства, позволившие снизить расход анестетиков и опиатов.
По мнению авторов, комбинация
различных полезных свойств в одном препарате, каковым является ДМТ, позволит
решить многие проблемы при особо стрессогенных хирургических вмешательствах.
Антисеротониновые препараты
(кетансерин, пиренперон, бутансерчн) блокируют специфические
рецепторы серотонина; кроме блокады 5-НТ2-рецепторов антисеротониновые средства (АС)
взаимодействуют с дофаминергическими, а1- и а2-адренергическими и Н1-рецепторами гистамина. Таким
образом, при воздействии АС снижается выраженность комплекса, возникающего при
возбуждении серотонином активности симпатоадреналовой системы, сопровождающейся
выбросом гистамина. Основу «альфалептаналгезии» (de Castro J., цит. по А.В. Мещерякову) составляет сочетание АС
(кетансерин — 0,4 мг/кг или бутансерин — 0,03 мг/кг) с гипнотиком (этомидат) и
аналгетиком (фентанил, альфентанил).
Рекомендуемая литература:
Britton J.T., Hannallah R.S., Schafer P.G., Norden J.M. Comparison of induction and recovery characteristics of propofol,
thiopental and halotane in children / YCanadian J. ofAnaesth.—1991. 38 (Suppi):
A 146.
Coates D.P. Experience with propofol in
outpatient surgery // New Horizonts in Anaesthesia: Focus on Propofol. Toronto:
MES Medical Education Services.—1989.— P.27— 33.
Davison J.K., Eckhardt III W.F., Perese D.A.
Clinical Anesthesia Procedures of the Massachusetts General Hospital, 4-th
Edition.—1993.— 711 p.
Deramoudt V., Gaudon M., Malledant Y. et
al. Effect of propofol on intraocular pressure during paediatric squint
surgery//Ann. Francaises d'Anesthesie et de Reanimation, 1990.—9.—P. 1—5.
Glen J.B. Interactions between intravenous anaestetic
agents and suxamethonium in mice//Br. J. of Pharmacology.—1977.—V. 61.—P. 487.
Glen J.B. Animal studies of the anaesthetic activity of
ICI 35,868// Br.J. ofAnaesth., 1980, 52, p 731—46.
Glen J.B. and Hunter S.C. Pharmacology of an emulsion
formulation of ICI 35,868//Br.J. of Anaesthesia.—1984a.—V. 56.—P. 617—626.
Glen J.B., Hunter S.C. et al. Interaction studies
and other investigation of the pharmacology of propofol
(«Diprivan»)//Postgraduate Medical J.— 1985—V. 61—P. 7—14.
Grounds R.M., Moore M., Morgan M. The
relative potencies of thiopentone and propofol//European J. of
Anaesthesiology.—1986.—V. 3.— P. 11—17.
Kallar S.K., Everett L.L. Desflurane versus
propofol for outpatient laparoscopic surgery//Anesthesiology.—1991.—V. 75.—A.9.
Koch E., Treede R.D., Schulte am Esch J., Bromm B. Modulation of Pain-Related Somatosensory Evoked Potentials by General
Anesthesia//Anesth. Analg., 1990.—V 71.—P. 225—230.
Ramani R. et al. Dose-related changes in CBF and CMR02
during infusions in rabbits Rapp S.E., Conahan T.J., Pavlin D.J. et al. A
comparison ofdesflurane with //Anaesth.—1990—V. 73-A.—P. 703.
Rapp S.E. Conahan T.J., Pavlin D.J. at
al. A comparision of desflurane with propofol in outpatients undergoing
peripheral orthopedic surgery// Anesthesiology.—1991.—V. 75.—A. 12.
Roily G., Versichelen L., Herregods L.
Cumulative experience with propofol (Diprivan) as an agent for the induction
and maintenance of anaesthesia//Postgraduate Medical J.—1985.—V. 61 (S.3).—P.
96—100.
Sung Y.F., Reis N., Tillette T. The
differential cost of anesthesia and recovery with propofol-nitrous oxide
anesthesia versus thiopental-isoflurane-nitrous oxide//Anesth. Anal.—1990.—V.
70 (S).—P. 396.
Sung Y.F., Reis N., Tillette T. The
differential cost of anesthesia and recovery with propofol-nitrous oxide
anesthesia versus thiopental sodium-isoflurane-nitrous oxide
anesthesia//}.Clin. Anesth.—1991.— V. 3.—P. 391—394.
Van Hemelriyck J. et al. Effects of propofol
on cerebral circulation and autoregulation in the babooiV/Anesth. and
Analg.—1990.—V. 71.— P. 49—54.
Varner P.D. et al. Survival during
severe hypoxia and propofol or ketamine anaesthesia in mice.//Anesth., 1988.—V.
69, A 571.
Werner С., Hoffman W.E., Kochs E. Effect of propofol on cerebral and spinal cord blood flow
autoregulation in rats.//Anesthesiology.— 1990.—A.—V. 73—P. 556.
Wrigley S.R., Fairfield J.E., Jones R.M., Black A.E. Introduction and recovery characteristics of desflurane in day
case patients: a comparison with propofol.//Anaesth.—1991.—V. 46.—P. 615—622.
Глава 12
ОБЩАЯ
ИНГАЛЯЦИОННАЯ АНЕСТЕЗИЯ
В.В. Лихванцев
Современные ингаляционные
анестетики гораздо менее токсичны (и это будет показано ниже), чем их
предшественники, и в то же время гораздо более эффективны и управляемы. Кроме
того, современная наркозно-дыхательная аппаратура позволяет значительно
сократить их интраоперационный расход за счет использования так называемой
низкопоточной техники анестезии — «LOW FLOW ANAESTHESIA».
Когда мы говорим о
современных ингаляционных анестетиках, то имеем в виду в первую очередь
энфлюран и изофлюран, хотя в настоящее время успешно заканчиваются испытания
последнего поколения парообразующих анестетиков — севофлюрана и десфлюрана.
Сравнительная характеристика
некоторых современных парообразующих анестетиков (J.
Davison et al., 1993)
|
Анестетик |
Давление газа (MMHg) при 20° С |
Коэффициент распределения кровь/газ (37° С) |
Коэффициент распределения мозг/кровь (37° С) |
МАК % атм. при чистом кислороде |
|
Галотан |
243 |
2,3 |
2,0 |
0,74 |
|
Энфлюран |
175 |
1,8 |
1,4 |
1,68 |
|
Изофлюран |
239 |
1,4 |
1,6 |
1,15 |
|
Десфлюран |
664 |
0,42 |
1,3 |
6,0 |
|
Севофлюран |
157 |
0,69 |
1,7 |
2,05 |
Примечание. МАК — минимально
альвеолярная концентрация — чрезвычайно важная величина для характеристики
любого парообразующего анестетика и показывает концентрацию парообразующего
анестетика, при которой 50% пациентов не проявляют двигательной активности в
ответ на кожный разрез.
МЕХАНИЗМ ДЕЙСТВИЯ
Предполагается, что
ингаляционные анестетики действуют через клеточные мембраны в ЦНС, однако
точный механизм не известен. Относятся к группе полисинаптических ингибиторов.
ФАРМАКОКИНЕТИКА
Скорость, с которой
ингаляционные анестетики абсорбируются и выводятся (изофлюран >энфлюран
>галотан), определяется коэффициентом распределения газ/кровь (см. табл.
12.1); чем меньше растворимость, тем быстрее поглощение и выделение.
Основной путь выделения всех
парообразующих анестетиков — в неизменном виде через легкие. Однако любой из
описываемых препаратов частично метаболизируется в печени, но — и в этом одно
из больших преимуществ современных анестетиков — в печени метаболизируется 15%
галотана, 2% энфлюрана и только 0,2 % изофлюрана.
ФАРМАКОДИНАМИКА
Центральная
нервная система
В низких концентрациях
ингаляционные анестетики вызывают амнезию (25% МАК). С увеличением дозы прямо
пропорционально растет угнетение ЦНС. Они увеличивают внутримозговой кровоток
(галотан >энфлюран >изофлюран) и снижают интенсивность метаболизма мозга
(изофлюран >энфлюран >галотан).
Сердечно-сосудистая
система
Ингаляционные анестетики
вызывают дозазависимое угнетение сократимости миокарда (галотан >энфлюран
>изофлюран) и уменьшение общего периферического сопротивления (изофлюран
>энфлюран >галотан), за счет периферической вазодилата-ции. Они не влияют
на ЧСС, может быть, за исключением изофлюрана, вызьшающего легкую тахикардию.
Кроме того, все ингаляционные
анестетики повышают чувствительность миокарда к действию аригмогенных агентов
(адреналин, атропин и т.д.), что следует учитывать при их совместном
применении.
Система
дыхания
Все ингаляционные анестетики
вызывают дозазависимую депрессию дыхания с уменьшением частоты дыхания, приходящим
увеличением объема дыхания и увеличением парциального давления углекислого
газа в артерии. По степени угнетения дыхания в эквимолярных концентрациях они
располагаются в порядке убывания: галотан — изофлюран — энфлюран, таким
образом, энфлюран является препаратом выбора при анестезии с сохраненным
спонтанным дыханием.
Они также обладают и
бронходилатационной активностью (галотан >энфлюран >изофлюран), что можно
использовать в соответствующей ситуации.
Печень
Ингаляционные анестетики
вызывают тенденцию к уменьшению органного кровотока в печени. Это угнетение
особенно выражено при анестезии галотаном, менее — энфлюраном и практически
отсутствует при применении изофлюрана. Как редкое осложнение наркоза галотаном,
описано развитие гепатитов, что послужило основанием к ограничению
использования данных препаратов у больных с заболеванием печени. Однако в
последнее время вероятность развития гепатитов под влиянием энфлюрана, и
особенно изофлюрана, подвергается серьезным сомнениям.
Мочевыделительная
система
Ингаляционные анестетики
снижают почечный кровоток двумя путями: за счет снижения системного давления и
увеличения ОПС в почках. Флуорид-ион — продукт распада энфлюрана — обладает
нефротоксическим действием, однако его действительная роль при длительной
анестезии энфлюраном остается недостаточно изученной.
Исследования последних лет
показали, что комбинированная общая анестезия на основе
энфлюрана/изофлюрана/фентанила значительно эффективнее традиционно
используемых в нашей стране НЛА и других вариантов внутривенной анестезии (J. Kenneth Davison et al.,
1993, В.В. Лихванцев с соавт., 1993, 1994), возможно, за исключением анестезии
на основе дипривана (пропофола) и фентанила. Это становится особенно очевидным
при анестезиологическом обеспечении длительных и травматичных операций на
органах брюшной полости, легких, магистральных сосудах, сердце. Снижение
суммарной дозы наркотических аналгетиков и быстрая элиминация парообразующего
анестетика способствуют быстрому пробуждению и ранней активизации больного, что
является весьма ценным фактором, заставляющим предпочесть именно данный вариант
инграоперационной защиты.
МЕТОДИКИ
АНЕСТЕЗИИ
Обычно метод анестезии
парообразующими анестетиками предполагает стандартную премедикацию, вводный
наркоз барбитуратами или пропофолом (у детей — парообразующим анестетиком).
Далее возможны два варианта поддержания анестезии:
1. Использование паров
анестетика в минимальной концентрации (0,6—0,8 МАК) на фоне стандартной НЛА
для стабилизации основных показателей гомеостаза пациента. Клиника такой
анестезии мало отличается от типичной для НЛА, хотя заметно менее выраженными
становятся колебания основных показателей гомеостаза при изменении хирургической
ситуации.
2. Использование
существенных концентраций (1,0—1,5 МАК) парообразующего анестетика с
добавлением значительно меньших доз фентанила. В данном случае сказьшаются все
преимущества ингаляционной анестезии с постоянством констант гомеостаза и более
ранним пробуждением.
Конечно, чисто технически
ингаляционная анестезия несколько сложнее, чем ТВА, так как требует возможно
лучшего испарителя и, желательно, хорошего герметичного наркозно-дыхательного
аппарата, позволяющего эффективно работать по полузакрытому контуру. Все это
повышает стоимость анестезиологического пособия.
В этой связи заслуживает
внимания недавно предложенная методика низкопоточной анестезии. Она заключается
в работе по полузакрытому контуру с минимальной подачей в него «свежей»
газонаркотической смеси, до 3 л/мин и менее (менее 1 л/мин — Minimum Flow Anaesthesia). Естественно, что чем
меньше поток газа через испаритель, тем меньше захват анестетика и, следовательно,
— расход. Учитывая, что современные ингаляционные анестетики практически не
метаболизируются и выводятся через легкие в неизменном виде (см. выше),
они способны долго циркулировать в контуре пациента, поддерживая состояние
анестезии. Используя данный метод, удается снизить расход ингаляционного
анестетика в 3—4 раза, по сравнению с традиционной методикой.
ЗАКИСЬ
АЗОТА
Закись азота — газ без цвета
и запаха, поступает в сжатом виде, в баллонах.
Механизм действия считается
общим для всех газовых анестетиков (см. предыдущий раздел).
Основным путем элиминации
является выведение в неизменном виде с выдыхаемой смесью. Наличие
биотрансформации в организме не показано.
Закись азота вызывает
дозазависимую аналгезию. При концентрации во вдыхаемом газе свыше 60%
возникает амнезия. Большинство наркозных аппаратов не позволяет увеличивать FiN2O более
70% из-за опасности создания гипоксической смеси.
Закись азота обладает
минимальным влиянием на сердечно-сосудистую систему и систему дыхания.
Тем не менее в последние
годы пересмотрено отношение к закиси азота как к «совершенно безопасному»
анестетику. Это связано с обнаруженными фактами проявления кардиодепрессивного
эффекта препарата, особенно у больных со скомпрометированной
сердечно-сосудистой системой (Н. А. Трекова, 1994). Кроме того, показано, что N2O
инактивирует метионин — сингетазу, В12-зависимый фермент,
необходимый для синтеза ДНК, и, таким образом, должна с осторожностью
использоваться во время беременности и у пациентов с дефицитом витамина В12.
Рекомендуемая литература:
Davison J.K., Eckhardt III W.F., Perese D.A.
Clinical Anesthesia Procedures of the Massachusetts General Hospital, 4-th
Edition.—1993.— 711р.
Лихванцев В.В., Смирнова
В.И., Ситников А.В., Субботин В.В., Смицкая О.И. Применение методики
регистрации вызванных потенциалов головного мозга для оценки эффективности
обезболивания во время общей анестезии//Конф.: «Патофизиология и фармакология
боли», 19—21 окт. 1993г.: Тез. докл.—С. 70.
Лихванцев В.В., Смирнова
В.И., Ситников А.В., Субботин В.В. Сравнительная оценка эффективности различных
вариантов общей анестезии при травматичных операциях на органах грудной и брюшной
полости//Материалы IV Всероссийского съезда анестезиологов и
реаниматологов.—М., 1994.—С. 196—197.
Трекова Н.А. Материалы IV Всероссийского
съезда анестезиологов и реаниматологов.—М., 1994.—С. 297.
Глава 13
МЫШЕЧНЫЕ
РЕЛАКСАНТЫ
А. У. Лекманов
НЕЙРОМЫШЕЧНОЕ ПРОВЕДЕНИЕ
Типичный моторный нейрон
состоит из тела клетки с легко различимым ядром, множества дендритов и
одиночного миелинизированного аксона. Аксоны от других нейронов сходятся на
дендритах и теле клетки. Эти аксонодендритные и аксоносоматические синапсы и
обеспечивают пре- и постсинаптическое торможение и пресинаптическое облегчение.
В зоне нервно-мышечного синапса аксон теряет свою миелиновую оболочку и
приобретает вид характерных выпячиваний. Аксоплазма этих выпячиваний содержит
вакуоли, наполненные медиатором нервно-мышечного проведения — ацетилхолином
(АХ).
Для синтеза АХ необходимы
холин и ацетат. Они попадают в аксоплазму из омывающей экстрациллюлярной
жидкости и затем хранятся в мигоховдриях в виде АцетилкоэнзимаА (АкоА). Другие
молекулы, используемые для синтеза и хранения АХ, синтезируются в теле клетки и
транспортируются к окончанию нерва. Главным ферментом, катализирующим синтез АХ
в окончании нерва, является холин-0-ацетилтрансфераза. АХ остается в
цитоплазме до тех пор, пока не попадает в вакуоли и не транспортируется в
места выброса. Назначение АХ, оставшегося в цитоплазме клеток, до настоящего
времени не вьмснено. Вакуоли располагаются в треугольных массивах, вершина которых
включает утолщенную часть мембраны, известную как «активная зона». Места
«разгрузки» вакуолей находятся на любой стороне этих активных зон,
выравниваемых точно по противоположным «плечам» — изогнутостям на
постсинаптической мембране. Постсинапгические рецепторы сконцентрированы как
раз на этих «плечах».
Современное понимание
физиологии нервно-мышечной передачи подтверждает «квантовую теорию». В ответ
на потенциал действия нерва реагирующие на напряжение кальциевые каналы
открываются, и ионы Са++ быстро входят в окончание нерва, соединяясь
с кальмодулином. Комплекс Са++ и кальмодулина вызывает
взаимодействие везикул с мембраной окончания нерва, что, в свою очередь,
приводит к выбросу АХ в синапс. Количество выброшенного посредника определяется
концентрацией внутриклеточного Са++ и временем открытия кальциевых
каналов. «Неквантовый» выброс Са++ также имеет место, однако его
роль не вполне ясна.
Быстрая смена возбуждения
требует, чтобы нерв увеличил количество АХ, — процесс, известный как мобилизация.
Мобилизация включает транспорт холина, синтез АкоА и движения вакуолей к месту
выпуска. При нормальных условиях нервы способны мобилизовать посредник (в
данном случае — ацетилхолин) достаточно быстро, чтобы заменить тот, который был
реализован в результате предыдущей передачи. В присутствии d-тубокурарина (d-TK)
мобилизация передатчика замедлена, выброс ацетилхолина не в состоянии
обеспечить темп поступаемых команд (стимулов), в результате мышечный ответ
падает или прекращается.
Освобожденный АХ пересекает
синапс и связывается с никотиновыми рецепторами постсинаптической мембраны.
Эти рецепторы состоят из пяти субъединиц, две из которых идентифицированы и
содержат места связывания для АХ. Образование комплекса АХ и рецептора приводит
к конформационным изменениям ассоциированного специфического белка, в
результате чего открываются катионные каналы. Ионы Na+ и Са++
двигаются внутрь, а ионы K+ из клетки, возникает электрический потенциал,
который передается на соседнюю мышечную клетку. Если этот потенциал превышает
необходимый порог для смежного мускула, возникает потенциал действия, который
проходит через мембрану мускула и инициализирует процесс сокращения. Величина
сокращения мускула не зависит от возбуждения нерва и величины потенциала действия
(являясь процессом, известным как «все или ничего»), но зависит от количества
мышечных волокон, вовлеченных в процесс сокращения. В норме количество
выбрасываемого АХ и постсинаптических рецепторов значительно превышает порог,
необходимый для мышечного сокращения.
Реполяризация мембраны
происходит после разрушения комплекса рецептора с АХ и биодеградацией
последнего под влиянием ацетилхолинэстеразы, которая постоянно присутствует в
синапсе.
КЛАССИФИКАЦИЯ
МЫШЕЧНЫХ РЕЛАКСАНТОВ
Хорошо известно, что все мышечные
релаксанты подразделяются на две большие группы в зависимости от механизма их
действия: деполяризующие и недополяризующие (конкурентные).
Механизм действия
недеполяризующих (антидеполяризующих) мышечных релаксантов связан с
конкуренцией между последними и АХ за специфические рецепторы (поэтому они еще
называются конкурентными). Вследствие этого резко снижается
чувствительность постсинаптической мембраны к воздействию ацетилхолина. В
результате действия конкурентных релаксантов на нервно-мышечный синапс его
постсинаптическая мембрана, находящаяся в состоянии поляризации, теряет
способность переходить в состояние деполяризации, и, соответственно, мышечное
волокно теряет способность к сокращению. Именно поэтому эти препараты и
называются недеполяризующими.
Прекращение нейромышечной
блокады, вызванной антидеполяризующими блокаторами, может быть облегчено при
использовании антихолинэстеразных препаратов (неостигмин, прозерин):
нарушается обычный процесс биодеградации АХ, концентрация его в синапсе резко
возрастает, и в итоге он конкурентно вытесняет релаксант из его связи с
рецептором. Следует помнить, однако, что время действия ангихолинэстеразных
препаратов ограничено, и если конец их действия наступает до разрушения и
выведения мышечного релаксанта, возможно повторное развитие нервно-мышечного
блока, — ситуация, известная клиницистам как рекураризация.
Миопаралитический эффект
деполяризующих мышечных релаксантов (сукценилхолин, листенон, дигилин,
миорелаксин) связан с тем, что они действуют на постсинапгическую мембрану
подобно ацетилхолину, вызывая его деполяризацию и стимуляцию мышечного
волокна. Однако вследствие того что они не удаляются немедленно с рецептора и
блокируют доступ ацетилхолина к рецепторам, резко снижается чувствительность
концевой пластинки к ацетилхолину. Более того, относительно устойчивая
деполяризация, которую вызывают деполяризующие мышечные релаксанты,
недостаточна для сохранения мышцы в сокращенном состоянии, так что мышца
остается расслабленной.
Понятно, что использование
антихолинэстеразных препаратов в качестве антидотов деполяризующих мышечных
блокаторов будет не эффективно, так как накапливающийся ацетилхолин будет
только усиливать деполяризацию и, следовательно, усугублять, а не уменьшать
степень нейромышечной блокады.
Интересно, что во всех
случаях даже однократного введения деполяризующих релаксантов, не говоря уже о
введении повторных доз, на постсинаптической мембране обнаруживаются в той или
иной степени изменения, когда исходная деполяризующая блокада сопровождается
блокадой недеполяризующего типа.
Это так называемая вторая
фаза действия («двойной блок») деполяризующих релаксантов. Механизм
второй фазы действия до настоящего времени не известен. Однако ясно, что вторая
фаза действия может в последующем устраняться антихолинэстеразными
препаратами и усугубляться недеполяризующими мышечными релаксантами.
Помимо изложенной
классификации, Savarese J. (1970) предложил все
мышечные релаксанты разделять в зависимости от длительности вызываемого ими
нейромышечного блока:
ультракороткого действия —
менее 5—7 мин, короткого действия — менее 20 мин, средней длительности — менее
40 мин и длительного действия — более 40 мин (табл. 13.1).
Классификация
мышечных, релаксантов по механизму и длительности действия
|
Деполяризующие релаксанты |
Недеполяризующие релаксанты |
||
|
ультракороткого действия |
короткого действия |
среднего действия |
длительного действия |
|
Суксаметоний (Листенон, Анектин, Дитилин,
Миорелаксин) |
Мивакуриум (Мивакрон) |
Атракуриум (Тракриум) Векурониум (Норкурон)
Рокурониум (Эсмерон) Цисатракуриум (Нимбекс) |
Пипекурониум (Ардуан) Панкурониум (Павулон)
Тубокурарин (Тубарин) |
Надо отметать, что для
характеристики нейромышечного блока используются такие показатели, как начало
действия препарата (время от окончания введения до наступления полного блока),
длительность действия (длительность полного блока) и период восстановления
(время до восстановления 95% проводимости). Точная оценка приведенных
характеристик проводится на основании миографического исследования с
электростимуляцией. Разделение это достаточно условно и к тому же в
значительной степени зависит от дозы релаксанта.
Клинически важно, что начало
действия — это время, через которое может быть проведена интубация трахеи в
комфортных условиях; длительность блока — это время, через которое требуется
следующая доза введения мышечного релаксанта для продления эффективной
миоплегии; период восстановления — это время, когда может быть выполнена
экстубация трахеи и больной способен к адекватной самостоятельной вентиляции.
Следует подчеркнуть
условность разделения мышечных релаксантов по длительности действия. Помимо
дозы препарата, начало, длительность действия и период восстановления нейромышечной
проводимости в значительной мере зависят от многих факторов, в частности
метаболизма препаратов, особенностей их экскреции из организма, функции
печени, почек и др.
Для суждения о потенции
мышечного релаксанта введена величина ED95, т.е. доза мышечного
релаксанта, необходимая для 95% подавления сократительной реакции отводящей мышцы
большого пальца в ответ на раздражение локтевого нерва. Величина ED95 зависит от используемой
анестезии и обычно указывается для опиоидной неингаляционной анестезии. Для
интубации трахеи, как правило, используется две или даже три ED95. Надо отметить, что дети
старше 6 месяцев имеют ряд особенностей в отношении потенции мышечного
релаксанта. Помимо общих фармакокинетических особенностей детского организма,
это может быть связано с большим числом никотиновых рецепторов, резервами АХ,
активностью холинэстеразы и меньшей чувствительности нейромышечных синапсов. В
связи с этим при введении эквипотенциальных доз мьпыечных релаксантов начало
действия, длительность и восстановление у детей быстрее, а поэтому ED95 у детей выше, чем у взрослых
пациентов.
ОСОБЕННОСТИ ДЕЙСТВИЯ ДЕПОЛЯРИЗУЮЩИХ
МЫШЕЧНЫХ РЕЛАКСАНТОВ
Единственными препаратами
ультракороткого действия являются деполяризующие мышечные релаксанты. В
основном это препараты суксаметония — сукцинилхолин, листенон, дитилин,
миорелаксин. Особенности нейромышечного блока при их введении состоят в
следующем.
• Полная нервно-мышечная
блокада возникает в течение 30—40 сек. Обычно они используются в схеме вводного
наркоза для проведения интубации трахеи. Отметим, что ED95 для суксаметония составляет
0,4—0,5 мг/кг. Обычно суксаметоний вводится для интубации трахеи в дозах
от 1 до 2 мг/кг веса.
• Длительность блокады
достаточно коротка, обычно 4—6 мин. Поэтому они используются обычно или только
для эндотрахеальной интубации с последующим переходом на недеполяризующие
препараты или при проведении коротких процедур (например, бронхоскопия под
общей анестезией), когда для удлинения миоплегии может применяться их дробное
дополнительное введение.
• Деполяризующие релаксанты
вызывают мышечные подергивания. Они проявляются в виде судорожного
подергивания и сокращения мышц, которые начинаются с момента введения
деполяризующих релаксантов и затихают приблизительно через 40 с. Вероятно, этот
феномен связан с одновременной деполяризацией большей части нейромышечных
синапсов. Мышечные фибрилляции могут вызвать ряд отрицательных последствий для
больного, и поэтому для их предотвращения используются, с большим или меньшим
успехом, различные методы. Чаще всего — это предшествующее введение небольших
доз недеполяризующих релаксантов (прекураризация). Главные отрицательные
последствия мышечных фибрилляции:
— появление у больных
послеоперационных мышечных болей;
— высвобождение калия, что
может привести к остановке сердца у больных с исходной гиперкалиемией.
• Деполяризующие релаксанты
повышают внутриглазное давление. Поэтому они должны использоваться с осторожностью
у больных с глаукомой, а у больных с проникающими ранениями глаза их применения
надо по возможности избегать.
• Введение деполяризующих
мышечных релаксантов может провоцировать наступление синдрома злокачественной
гипертермии.
• Так как деполяризующие
релаксанты в организме разлагаются плазменной холинэстеразой, качественная или
количественная недостаточность этого фермента, которая встречается у 1 на 3000
пациентов, вызывает чрезмерное удлинение блока.
• При введении
деполяризующих релаксантов может в той или иной степени наступать вторая фаза
действия (развитие недеполяризующего блока), что в клинике проявляется непрогнозируемым
удлинением блока.
• Существенным недостатком
препаратов этой группы является их высокий гистамин-эффект.
Хотя деполяризующие мышечные
релаксанты остаются непревзойдёнными препаратами для проведения экстренной или
осложненной интубации трахеи, отрицательные эффекты заставляют отказываться от
их применения и использовать недеполяризующие препараты.
ОСОБЕННОСТИ ДЕЙСТВИЯ НЕДЕПОЛЯРИЗУЮЩИХ
МЫШЕЧНЫХ РЕЛАКСАНТОВ
К недеполяризующим относятся
препараты короткого, среднего и длительного действия. В настоящее время чаще
всего в клинической практике используются препараты стероидного и
изохинолинового рядов.
Недеполяризующие
миорелаксанты имеют следующие характерные особенности:
• вызьшают наступление
нейромышечной блокады в течение 1—5 мин (в зависимости от вида препарата и его
дозы), что значительно медленнее по сравнению с деполяризующими препаратами;
• длительность нейромышечной
блокады, вызванной недеполяризующими релаксантами, также значительно
превосходит длительность действия деполяризующих релаксантов и зависит от вида
препарата, различаясь от 15 до 60 мин;
• в отличие от
деполяризующих блокаторов введение препаратов недеполяризующего ряда не
сопровождается мышечными фибрилляциями и вследствие этого — послеоперационными
мышечными болями и высвобождением калия;
— окончание нейромышечного
блока с его полным восстановлением может быть ускорено с помощью введения
антихолинэстеразных препаратов, хотя делать это рекомендуется в исключительных
случаях из-за опасности рекураризации. Правилом должно стать: «Лучше продлить
ИВЛ на некоторое время и добиться самостоятельного восстановления спонтанного
дыхания, чем форсировать переход на самостоятельную вентиляцию и страдать от
последствий рекураризации»;
— одним из недостатков
большинства недеполяризующих мышечных релаксантов является кумулирование всех
препаратов этой группы. Наименее выражен данный эффект у тракриума и нимбекса;
— другим существенным
недостатком этих препаратов является зависимость характеристик вызываемого
нейромышечного блока от функции печени и/или почек. У больных с нарушением
функций этих органов длительность блока и особенно восстановление могут
значительно увеличиться.
ХАРАКТЕРИСТИКА НЕДЕПОЛЯРИЗУЮЩИХ МЫШЕЧНЫХ
РЕЛАКСАНТОВ
Препараты этой группы
разделяются между собой как по времени начала действия, длительности блока и
его восстановления, так и по их влиянию на различные органы и системы. В
России в настоящее время используются следующие препараты:
Тубокурарин хлорид. Является производным
изохинолинов и выпускается под различными коммерческими названиями. В
настоящее время используется редко из-за выраженного кумулятивного и
гистаминогенного эффектов. Обычная доза — 0,3—0,4 мг/кг веса, причем полная
релаксация при введении в клинически рекомендуемых дозировках наступает через
3— 5 мин. Длительность действия составляет 35—45 мин, причем повторные дозы
уменьшают в 2—4 раза по сравнению с первоначальной.
До настоящего времени
остается невыясненным процесс инактивации тубарина. Известно, что выделяется он
в основном с мочой, причем около 40% его выводится в неизменном виде. Поэтому
он должен с осторожностью применяться у больных со скомпрометированной функцией
почек. Кроме того, тубокурарин обладает специфическим ганглиоблокирующим действием, в связи с чем
его введение может вызвать существенное снижение артериального давления (обычно
на 20—25 мм рт. ст.).
Панкурониум. Выпускается под коммерческим
названием «павулон». Панкурониум, как и другой недеполяризующий мышечный
релаксант — пипекурониум (широко известный у нас под коммерческим
названием «ардуан»), является стероидньм соединением, не обладающим
гормональной активностью. После введения начальной дозы 0,05—0,08 мг/кг интубация
трахеи может быть проведена через 3—4 мин. Мышечная релаксация продолжается
40—50 мин. Для повторного введения доза снижается в 3—4 раза, причем с
увеличением дозы и кратности введения увеличивается кумулятивный эффект. Время
90% восстановления контрольной высоты мышечных сокращений при релаксографии
составляет около 65 мин. Выделяются из организма с мочой, хотя в некоторой
степени экскретируются желчными путями. Один из метаболитов панкурониума
обладает примерно половинной активностью исходного препарата, что может быть
одной из причин кумулятивного эффекта. Существенньм достоинством препаратов
этой подгруппы является довольно низкий гистамин-высвобождающий эффект.
Векурониум. Аминостероидный мышечный
релаксант средней продолжительности действия, выпускается под названием
«норкурон». Активность этого релаксанта несколько выше, чем у панкурониума,
и в 8,5 раз выше, чем у тубокурарина. ED95 для взрослых больных
составляет 0,043 мг/кг, для детей — 0,06 мг/кг. При введении его в/в в дозах
0,08— 0,1 мг/кг веса через 1,5—2,5 мин наступает состояние миоп-легии, и может
быть выполнена интубация трахеи. Отмечено, что в зависимости от дозы векурониум
может рассматриваться или как релаксант средней продолжительности действия,
либо, при увеличении дозы до 4 х ED95, как миорелаксант
длительного действия. Длительность действия препарата при обычных дозировках
обычно составляет около 20—35 мин, при повторном введении — до 60 мин. Для
постоянной инфузии рекомендуется скорость введения 0,03—0,06 мг/кг/ч. Из
организма векурониум экскретируется главньм образом с помощью печени и
частично через почки, так что нарушение функции этих органов ограничивает его
использование. Один из метаболитов векурониума (3-ОН метаболит) обладает
фармакологической активностью, так что с ним могут быть связаны кумулятивные
качества препарата. Векурониум редко вызывает сердечно-сосудистые осложнения и
обладает низким гистамин-высвобождающим эффектом.
Атракуриум. Выпускается под коммерческим
названием «тракриум». Является производным изохинолинового ряда.
Внутривенное введение атракуриума в дозах 0,3—0,5 мг/кг позволяет выполнить
интубацию трахеи через 1,5—2 мин. Длительность действия 20—35 мин. При
фракционном введении последующие дозы снижаются в 3—4 раза, при этом повторные
болюсные дозы продлевают мышечную релаксацию на 15—35 мин. Атракуриум очень
удобен при использовании в виде постоянной внутривенной инфузии. В организме
молекула атракуриума подвергается спонтанной биодеградации по механизму
саморазрушения без какого-либо участия ферментов. Этот механизм спонтанной
биодеградации препарата известен как элиминация Хофманна. Такое
разложение атракуриума происходит при рН около 7,40 (нормальный рН крови
человека) и физиологической температуре тела с постоянной скоростью, так что
период полувыведения препарата составляет около 20 мин. Поскольку химическая
структура атракуриума включает эфирную группу, в некоторой степени разложение
препарата (до 6%) может происходить в виде эфирного гидролиза. Существенно, что
ни один из образующихся при элиминации Хофманна и эфирном гидролизе
метаболитов атракуриума не обладает свойствами миорелаксанта. В связи с указанными
особенностями метаболизма атракуриум практически не кумулируется в организме.
Понятно, что обратимость нейро-мышечного блока не зависит ни от числа
дополнительных введенных доз, ни от возраста. Недостатком атракуриума является
его гистамин-высвобождающий эффект.
Мивакуриум. В 1995 г. в нескольких
клиниках России прошли клинические испытания нового недеполяризующего мышечного
релаксанта «мивакрон» (Glaxo-Wellcome, Великобритания),
единственного недеполяризующего релаксанта короткого действия. Этот препарат,
так же как и атракуриум, является производным изохинолинового ряда.
Особенности фармакокинетики двух главных изомеров мивакуриума состоят в том,
что они имеют очень высокий клиренс (выше минутного объема кровообращения) и
низкий объем распределения. Благодаря этому период полувыведения этих двух
изомеров составляет около 2 мин. Третий из изомеров мивакуриума имеет только
одну десятую потенции двух других изомеров в развитии нейромышечного блока,
поэтому считается, что, несмотря на достаточно длительный период полувыведения,
составляющий около 55 мин, он не нарушает характеристики нейромышечного блока
при инфузии мивакуриума. Мивакуриум в организме подвергается гидролизу
плазменной холинэстеразой. Небольшое количество мивакуриума выделяется в неизменном
виде с мочой и желчью. Возможны и другие пути его метаболизма, полностью до сих
пор не изученные. Существенно, что скорость метаболизма мивакуриума в
организме главным образом зависит от активности плазменной холинэстеразы.
Именно эта особенность фармакокинетики мивакуриума позволяет считать, что он
не кумулируется в организме. ED95 мивакуриума для взрослых
составляет 0,07 мг/кг, для детей — 0,1 мг/кг. Для интубации трахеи
рекомендуемая доза составляет болюсно однократно 0,20 мг/кг, что позволяет интубировать
трахею в течение 2—2,5 мин или дробно 0,15 и затем еще 0,10 мг/кг, тогда
интубация возможна в течение 1,5 мин.
Следует отметить, что
мивакуриум имеет исключительные параметры восстановления (в 2,5 раза короче
векурониума и в 2 раза — атракуриума), у взрослых 95% — восстановление
происходит в течение 20 мин, у детей — 15 мин. Мивакрон широко используется и
при достаточно длительных операциях, коща он вводится в виде инфузии. Однако
высокая цена препарата не позволяет надеяться на его широкое использование при
длительных оперативных вмешательствах в нашей стране. На сегодняшний день
мивакуриум является мышечным релаксантом выбора при операциях в стационаре
одного дня, в частности при эндоскопической хирургии. Также он может быть
рекомендован при операциях с непредсказуемой продолжительностью.
Рокурониум. Новый мышечный релаксант из
группы аминостероидов, выпускается под названием «эсмерон». Этот мышечный
релаксант обладает средней продолжительностью действия, его ED95 у взрослых составляет 0,3 мг/кг.
При использовании в дозах 0,6 мг/кг начало действия рокурониума быстрее, чем у
других релаксантов средней продолжительности действия, так что он может быть
приемлемой альтернативой суксаметонию для интубации трахеи, — она может быть
проведена в пределах
1 мин. Длительность нейромышечного блока при этом составляет около 30 мин, при
увеличении дозы длительность блока возрастает до 50—70 минут. Элиминация
препарата главным образом происходит с желчью. Препарат может вводиться в виде
болюсов и постоянной внутривенной инфузии. Рокурониум мало влияет на
артериальное давление, но может вызвать значительную тахикардию. Как и для
большинства других недеполяризующих релаксантов, длительность действия
рокурониума у детей короче, чем у взрослых.
Цисатракуриум. Новый мышечный релаксант
средней длительности. Представляет из себя один из 10 стереоизомеров
атракуриума. Подобно атракуриуму, в организме цисатракуриум («нимбекс»)
метаболизируется органонезависимым способом с помощью элиминации Хофманна. У
взрослых ED95 составляет 0,05 мг/кг. В дозах 0,15 мг/кг интубация
трахеи может быть произведена в пределах 2 мин при длительности действия 25— 40
мин. Обладая всеми выгодными качествами, присущими атракуриуму (возможность
интубации трахеи, предсказуемая длительность и восстановление блока,
независимый метаболизм и экскрекция), циатракуриум практически не обладает
гистамин-высвобождающим эффектом. Может вводиться как в виде болюсов, так и
перфузионно.
Оценивая современные
тенденции в использовании мышечных релаксантов в анестезиологии, следует
отметить прежде всего тенденцию к более частому использованию препаратов
короткой (там, где это показано) и средней длительности. При этом они вводятся
в виде постоянной внутривенной инфузии с использованием системы taget-controlled infusion или автоматических установок с системой обратной
связи.
Также следует иметь в виду,
что новорожденные более чувствительны к недеполяризующим мышечным релаксантам,
пожилые больные, наоборот, обладают повышенной чувствительностью к деполяризующим
препаратам и пониженной к недополяризующим.
МОНИТОРИНГ МЫШЕЧНОЙ РЕЛАКСАЦИИ
До последнего времени в
нашей стране мониторинг нейро-мышечной проводимости, к сожалению, использовался
только при научных исследованиях. Принцип нейромышечного мониторинга состоит в
том, что проводится изучение двигательной активности мьшщы в ответ на электрическую стимуляцию
нерва. Двигательная активность может определяться исследователем пальпаторно,
а также с помощью механомиографии, акселерометрии или (наиболее точно)
электромиографии. Наиболее популярно в клинической практике измерение функции
приводящей мышцы большого пальца при стимуляции локтевого нерва, хотя
сократительная способность круговой мьшщы глаза при стимулировании лицевого
нерва лучше коррелирует с дыхательной мускулатурой. Сначала записывается
исходный ответ, который принимается за 100%. Последующие измерения выполняются
уже после введения мьшгечного релаксанта, причем электростимуляция проводится
в режиме супрамаксимального раздражения (его определяют как нейромышечный
ответ, амплитуда которого не растет при дальнейшем увеличении силы раздражения,
плюс 10—20% к этой величине раздражающего импульса).
В анестезиологии используется
пять вариантов электрической стимуляции нерва: одиночный разряд, тетанический
импульс, TOF-стимуляция (train-of-four — серия из четырех),
посттетанический счет (РТС), стимуляция двумя разрядами (DBS-double burst stimulation). В последние годы чаще
всего для раздражения используется режим, который обозначается как TOF. Суть
такой методики заключается в том, что при включении этого режима в области
стимуляции через каждые 0,5 сек. подается всего 4 импульса (частота,
следовательно, составляет 2 Гц) подряд. Повторная стимуляция может быть
проведена через 12—15 сек. Данный режим хорошо переносится большинством
больных и позволяет не только оценить глубину блока (в современных приборах она
автоматически выводится на дисплее прибора), но и отличить недеполяризующий
блок от деполяризующего, при этом глубина блока соответствует процентному
отношению амплитуды первого ответа к амплитуде исходного ответа (t1/t0 в %). Во время
недеполяризующего блока Т1>Т2>Т3>Т4.
При деполяризующем блоке амплитуда всех зубцов одинакова.
Нейромышечный блок считается
адекватным для проведения анестезии при Т1 10% и менее от
контрольного (90%-ная супрессия).
Надо также напомнить, что
существуют и клинические критерии восстановления нейромышечного блока для
экстубации трахеи. Самым известным и надежным среди них является тест
поднятия головы — способность больного поднять голову и удерживать ее в
течение 5 сек. При проведении TOF-стимуляции этому соответствует приблизительно
70%-ное восстановление Т1.
На практике вопрос времени
экстубации трахеи решается строго индивидуально. Для создания комфортных условий
больному нет необходимости дожидаться восстановления ясного сознания, более
того, при появлении признаков сознания до восстановления адекватного мышечного
тонуса имеет смысл ввести субгипнотические дозы дипривана — 0,5 мг/кг. Критерии
готовности больного к экстубации:
— больной способен
поддерживать необходимый минутный объем дыхания и объем вдоха;
— сохраняется адекватное
насыщение гемоглобина артериальной крови кислородом (SaO2) и уровень выдыхаемого углекислого
газа (EtCO2) при самостоятельном дыхании.
Не следует забывать об
использовании вспомогательных режимов вентиляции: Pressure Support, BiPAP, Flow By и т.д.
Конечно, мониторинг
нейромышечного проведения существенно облегчает задачу анестезиолога.
Рекомендуемая литература:
Fukushima К., Ochiai R (Eds.). Muscle Relaxants. (Physiologic and Pharmacologic
Aspects.)//Springer-Verlag.—Tokyo, 1995.—415 p.
Глава 14
ИНТРАОПЕРАЦИОННАЯ
ОРГАНОПРОТЕКЦИЯ
В.В. Лихванцев
Стремление повысить
эффективность проводимой анестезии за счет целенаправленного воздействия на
наиболее уязвимые органы и системы привело к обоснованию необходимости
интраоперационной органопротекции (ИО).
Различные методики ИО можно
объединить в:
— холодовые (общая и
регионарная гипотермия);
— фармакологические
(проведение операций на поджелудочной железе на фоне инфузии цитостатиков);
— холодово-фармакологические
(кардиоплегия при операциях на «сухом» сердце).
Кроме того, ИО может быть:
— системной (профилактическое
введение эсмолола у больных с ИБС),
— местной (кардиоплегия — при
операциях на сердце; гепатоплегия — при операциях на печени).
В настоящем разделе опущено
описание методик местной ИО, так как данная проблема относится к
узкоспецифичным областям хирургии и выходит за рамки задач настоящего
руководства.
ОБЩАЯ ГИПОТЕРМИЯ
В настоящее время общая
гипотермия при сохраненной функции сердца находит ограниченное применение
из-за сомнительной эффективности и достаточно высокого риска, связанного с ее
проведением. Используется в основном при операциях на дуге и нисходящем отделе
грудной аорты для предупреждения ишемических повреждений спинного мозга, только
в нашей стране используется для операций на сердце в условиях остановки
кровообращения (Stop Flow) без аппаратного замещения
функций сердца и легких (Н.И. Мешалкин, 1994).
Принято различать:
— глубокую гипотермию
(температура крови менее 20°С);
— умеренную гипотермию
(температура крови от 21 до 28° С);
— поверхностную гипотермию
(температура крови 29°С и выше).
Следует иметь в виду, что у
лиц со скомпрометированным миокардом нарушения сердечного ритма могут появиться
уже при температуре 32—33°С. При температуре ниже 30°С, в условиях общей
анестезии парообразующими анестетиками, практически 100% пациентов имеют те
или иные нарушения ритма. В этой связи пациентов с сохраненным кровообращением
принято охлаждать до температуры 32—33°С.
Техника
проведения поверхностной гипотермии
Обязательное условие —
измерение полостной (ректальной или пищеводной) и кожной темепературы с
определением градиента. На всех этапах вмешательства градиент не должен превышать
1°С, максимально 2°С. Более высокий градиент свидетельствует о неравномерном
охлаждении (согревании), что может привести к серьезным расстройствам
гемодинамики и метаболизма.
После вводного наркоза
больного помещают в холодную ванну, или обкладывают пузырями со льдом, или
используют специальные термоматрацы. Охлаждение продолжают до температуры
33—34°С в пищеводе, после чего начинают операцию. При необходимости вводят
дроперидол (блокада центра терморегуляции) или вазодилататоры (с одной
стороны, усиливают эффективность теплоотдачи, с другой — препятствуют рефлекторному
вазоспазму). Следует иметь в виду, что после прекращения охлаждения возможно
спонтанное углубление гипотермии на 1—2°С. Температуру больного контролируют
использованием термокомпенсирующего матраца. Согревание начинают во время
выполнения основного этапа операции с тем, чтобы успеть согреть больного до ее
окончания.
Пробуждение или экстубация
несогретого больного нецелесообразны.
Возможные осложнения общей
гипотермии:
— неуправляемая гипотермия;
— нарушения ритма сердца;
— резкое увеличение ОПС;
— «мозаичное» согревание —
неравномерное согревание различных участков тела может привести к
неконтролируемым показателям КОС крови и выбросу кислых продуктов обмена.
Следует иметь в виду, что
метаболизм во время общей гипотермии снижен, а, следовательно, снижена и
скорость биодеградации лекарственных препаратов (релаксантов, наркотических
аналгетиков, бензодиазепинов и т.д.).
ФАРМАКОЛОГИЧЕСКАЯ ОРГАНОПРОТЕКЦИЯ
Глюкокортикоиды
Преднизолон, целестон, дексазон, дексаметазон и т.д. Использование гшококортикоидов для защиты от повреждающих факторов хирургического стресса и гипоксии связано с наличием у препаратов обсуждаемой группы мембраностабилизирующих свойств и их влиянием на процессы отека и набухания тканей. Стандартная доза преднизолона — 2—3 мг/кг вводится профилактически при любых травматичных и длительных операциях. Если есть основания предполагать ишемические повреждения тканей (нестабильная гемодинамика, временное выключение из кровообращения органа или региона), доза может быть увеличена до 20—25 мг/кг.
Даларгин
Даларгин — отечественный
синтетический стабильный аналог лей-энкефалина, гексапептид по химическому
строению. Период полувыведения препарата составляет 10—15 мин. Обладает
примерно одинаковой активностью по влиянию на мю- и сигма-опиатные
рецепторы. Продукты деградации даларгина, его концевые пента- и тетрапептидные
фрагменты обладают сравнимой с даларгином активностью по влиянию на сигма-опиатные
рецепторы.
Аналгетический потенциал
даларгина
При прямой аппликации на
структуры мозга по аналгетиче-ской активности даларгин на три порядка уступал
наиболее эффективному мю-опиатному агонисту FK-33824 и был сопоставим с
таковым у морфина. При в/в введении препарат уступал как FK-33824, так и
морфину. Учитывая, что гематоэнцефалический барьер практически непроницаем для
веществ пептидной природы, трудно ожидать от даларгина проявления клинически
значимой аналгетической активности при в/в введении.
Антистрессорное действие
даларгина
Даларгин приводит к снижению
стресс-индуцированного уровня АКТГ и кортизона в плазме, предотвращает развитие
гипоинсулинемии. Введение даларгяна улучшает микроциркуляцию и предупреждает
развитие централизации кровообращения при травматическом шоке.
Применение даларгина во
время анестезии
В нашей клинике было
показано, что применение даларгина при операциях на
гепато-панкреато-дуоденальной области существенно улучшает функциональное
состояние печени и поджелудочной железы. В крови регистрируется значимое уменьшение
уровня активности гепато- и панкреатоспецифичных ферментов.
Даларгин предупреждает
развитие стресс-индуцированных повреждений легких, существенно улучшает
альвеоло-артериальную диффузию газов, препятствует внутрилегочному шунгированию
крови, улучшая венгиляционно перфузионные соотношения.
Есть основания полагать
наличие у даларгина кардиопротекторных свойств.
По-видимому, даларгин
обладает общим неспецифическим защитным действием, вмешивается в интимные
процессы ауторегуляции гомеостаза, всякий раз направляя их к норме. Иными
словами, мы имеем дело с принципиально новым явлением — препаратом, основным
механизмом действия которого является активация (или торможение) эндогенных
систем, в любом случае направленное на поддержание гомеостаза. Даларгин как бы
демпфирует любые повреждающие воздействия, ослабляя влияние хирургического
стресса как на клетку или ткань, так и на организм в целом.
В молекулярной основе
цитопротекторного действия даларгина, по-видимому, лежит его способность
ингибировать процессы перекисного окисления липидов, уменьшать выброс свободных
радикалов в циркуляцию и таким образом стабилизировать цитоплазматические
мембраны клеток различных органов.
Кроме того, хотелось бы
отметить, что по своей химической структуре даларгин близок к естественным
метаболитам организма, практически безопасен для применения.
Для инграоперационной
органопротекции рекомендуется дозированная инфузия даларгина со скоростью
45—60 мкг/кг/час.
Побочных эффектов от введения
препарата не отмечено.
Глава 15
ПРИНЦИПЫ
ПРОВЕДЕНИЯ ОБЩЕЙ АНЕСТЕЗИИ
В.В. Лихванцев
Общая анестезия обязана
обеспечить аналгезию, амнезию, нейровегетативную защиту и оптимальные условия
для вьшол-нения хирургического вмешательства (например, миоплегию). При этом
первоочередной задачей анестезиолога является безопасность пациента.
Дискутабельным остается вопрос о необходимости обеспечения интраоперационной
органопротекции. При ряде оперативных вмешательств или в ситуации, когда этого
требует состояние больного, становится необходимым временное протезирование
ряда жизненно важных функций (например, искусственная вентиляция легких) и/или
управление ими (управляемая гипотензия, инотропная поддержка, балонная
контрпульсация и т.д.).
ПРЕДОПЕРАЦИОННАЯ
ПОДГОТОВКА
Как уже указывалось ранее,
анестезиолог участвует в предоперационной подготовке, которая может занимать от
нескольких минут до нескольких недель. Задачи и особенности предоперационной
подготовки обсуждались в соответствующих главах.
Накануне операции (плановое
вмешательство) анестезиолог окончательно определяет физический статус больного,
метод анестезиологического обеспечения (включая объем мониторинга) и назначает
премедикацию.
За 30—40 мин до плановой
операции сестра-анестезистка делает премедикацию и по согласованию с
анестезиологом дает разрешение на транспортировку больного в операционную. Анестезиолог
присутствует при выполнении премедикации и сопровождает больного в
операционную, если:
— это ребенок моложе 14 лет;
— это пациент старше 80 лет;
— физический статус больного
соответствует ASA III и выше;
— есть основания ожидать
нарушения дыхания (серьезные расстройства системы дыхания, отягощенный
аллергический анамнез, ожирение и т.д.) или кровообращения (пациент с нестабильной
стенокардией, угрожающими нарушениями ритма сердца и т.д.);
— вводный наркоз проводится в
палате (ребенок младшего возраста) или сознательно назначается «усиленная»
премедикация (эмоционально лабильный пациент, кризовое течение гипертонической
болезни и т.д.).
ПОДГОТОВКА
ПАЦИЕНТА В ОПЕРАЦИОННОЙ
Больной находится на
операционном столе в положении на спине с отведенной левой рукой, шея слегка
разогнута, голова покоится на специальном валике.
В операционной обеспечивают
условия комфорта:
— температура комфорта;
— укрывание больного до
момента вводного наркоза;
— тишина, профессиональные и
посторонние разговоры до вводного наркоза запрещены. Не допускается разговор о
пациенте в третьем лице.
Производится катетеризация
периферической вены катетером 16—18G и обеспечивается капельная
инфузия изотонического раствора хлорида натрия (исключение — кардиохирургия).
Катетеризация большего количества периферических вен или центральных вен
производится после вводного наркоза (исключение — выраженная гиповолемия,
требующая немедленной коррекции). Следует помнить, что даже у больного, не
имеющего причин для возникновения дефицита жидкости в организме, запрет на
прием пищи и жидкости (как элемент предоперационной подготовки) создает
дефицит объема примерно 15 мл/кг. Таким образом, целесообразно провести инфузию
500—750 мл раствора до начала вводного наркоза.
Если больной поступает с
канюлированной веной, убеждаются в правильности стояния катетера, меняют
инфузионную систему («капельницу»). Если пациент проявляет повышенное беспокойство
или по тем или иным причинам задерживается операция (вводный наркоз), эффект
премедикации усиливают дополнительным введением соответствующих препаратов
(мидазолам, диазепам).
На теле пациента фиксируют
электроды, датчики и манжеты для неинвазивного мониторинга. Измеряют и
фиксируют в наркозной карте исходные показатели пациента.
Под левую лопатку
подкладывают «ложку» дефибриллятора. Больной готов к вводному наркозу. Вводный
наркоз проводится в присутствии оперирующего хирурга, который готов приступить
к операции сразу же после разрешения анестезиолога.
ВВОДНЫЙ НАРКОЗ
Вводный наркоз — очень
ответственная процедура, в процессе которой происходит перевод пациента из
состояния бодрствования в состояние медикаментозного сна. Задача вводного
наркоза, или индукции, также обеспечить эффективный уровень анестезии для
ларингоскопии и интубации трахеи. Последняя манипуляция (интубация) в условиях
неадекватной анестезии может привести к развитию брадикардии и гипертензии.
После введения релаксантов и
короткого периода гипервентиляции производят ишубацию трахеи. Размер
ишубационной трубки в среднем: 8,0 — для взрослых мужчин, 7,0 — для взрослых
женщин. Считается, что диаметр ногтевой фаланги большого пальца руки
соответствует диаметру голосовой щели. Ларингоскопия и интубация трахеи не
должны занимать более 45—60 сек., у пациентов с ИБС и в кардиоанестезиологии —
30 сек.
В настоящее время у взрослых
пациентов, как правило, индукцию проводят, используя методику в/в введения
препаратов. Современные схемы вводного наркоза предусматривают использование
пропофола (диприван) или барбитуратов (тиопенгал, бриетал):
1. Барбитуровый (гексенал, тиопентал Na,
бриетал). Фармакология и фармакодинамика барбитуратов позволяют провести
вводный наркоз быстро, эффективно и с минимальным влиянием на системы
кровообращения и дыхания.
Схема вводного наркоза —
последовательно, в/в вводят:
— тракриум — 10 мг;
— атропин 0,1%-ный раствор —
0,5 мл для уменьшения саливации и предупреждения вагусных рефлексов при интубации
трахеи;
— бриетал в дозе 2—3 мг/кг в
виде приготовленного ех tempera 1%-ного раствора;
— фентанил в дозе 5 мкг/кг;
— листенон в дозе 2 мг/кг;
— интубация трахеи.
2. Вводный наркоз
пропофолом (диприваном). Относительное противопоказание, ввиду возможного
развития гипотонии (снижение АД на 25—40% исходных значений), —
некоррегированная гиповолемия.
Схема наркоза:
— тракриум — 10 мг;
— атропин 0,1%-ный раствор —
0,5 мл для уменьшения саливации и предупреждения вагусных рефлексов при
интубации трахеи;
— диприван в дозе 1,5—2,5 мг/кг;
— фентанил в дозе 5 мкг/кг;
— листенон в дозе 2 мг/кг;
— интубация трахеи.
Критерии эффективности
вводного наркоза:
— больной спит;
— зрачки сужены и фиксированы
по центру глазного яблока, реакция зрачка на свет отсутствует;
— мышцы расслаблены, челюсть
легко открывается;
— ресничный рефлекс
отсутствует или существенно угнетен.
Пациент может дышать
самостоятельно, но может и требовать вспомогательной вентиляции через маску. В
любом случае релаксанты вводят только при полной уверенности в проходимости
дыхательных путей.
У детей младшего возраста вводный
наркоз проводят в палате, для чего в/м вводят кетамин в дозе 5—7 мг/кг. Обязательно
присутствие врача на всех этапах (индукция, транспортировка).
Альтернативой подобной
методике является масочный наркоз галотаном: маску плотно фиксируют на лице
пациента и после короткого периода ингаляции кислорода, необходимого для
адаптации к дыханию через маску, начинают постепенно увеличивать концентрацию
галотана во вдыхаемой смеси.
Для предупреждения тошноты,
рвоты, выраженного возбуждения недопустимо резко увеличивать концентрацию
анестетика в дыхательном контуре.
Клиника общей анестезии была
впервые описана Guedel (1937) для ингаляционного наркоза эфиром при
сохраненном спонтанном дыхании. Он выделил четыре стадии наркоза (табл. 15.1).
В настоящее время описанную Guedel
клинику общей анестезии можно наблюдать разве что при проведении мононаркоза
парообразующими анестетиками, что на практике используется крайне редко.
Оценка адекватности современных методов комбинированной общей анестезии
(эффективности) будет изложена в соответствующей главе.
Стадии ингаляционного наркоза
(Guedel, 1937)
|
Стадии наркоза |
Описание |
|
I: амнезия |
Данный период начинается с момента индукции и
заканчивается потерей сознания. Болевая чувствительность на данной стадии
сохранена |
|
II: возбуждение |
Период, когда в ответ на болевой раздражитель могут
возникнуть судороги, тошнота, рвота, ларингоспазм, гипертензия, тахикардия.
Зрачки расширены, дыхание нерегулярное. Задача анестезиолога — используя
современные препараты, избежать или максимально сократить продолжительность
данной стадии |
|
III: хирургическая |
На этой стадии зрачки сужены, реакция на свет
отсутствует, дыхание спокойное, ровное; болевая стимуляция не вызывает
двигательной реакции и гемодинамического ответа (тахикардия, гипертензия и
т.д.) |
|
IV: передозировка |
Иначе называется слишком глубокой анестезией.
Характеризуется слабьм поверхностным дыханием (иногда — апноэ), гипотонией.
Зрачки расширены, реакция на свет отсутствует |
ПОДДЕРЖАНИЕ АНЕСТЕЗИИ
После достижения адекватного
уровня анестезии ее поддержание производится в соответствие с избранной
методикой. Хирургическое вмешательство начинается с разрешения анестезиолога,
после того как последний убедится в достаточной глубине наркоза и коррегирует
(если это необходимо) возникшие во время индукции сдвиги в системах поддержания
гомеостаза пациента.
Общая
анестезия парообразующими анестетиками
В настоящее время в «чистом»
виде используется крайне редко. Как правило, применяются мышечные релаксанты
(и, соответственно, ИВЛ). Комбинация с закисью азота позволяет уменьшить
расход основного анестетика, усилить аналгезию.
Центральная
аналгезия
Предусматривает использование
больших доз наркотических аналгетиков (50 и более мкг/кг/час фентанила) в
сочетании с ИВЛ (спонтанное дыхание невозможно, вследствие угнетения его
опиоидами) кислородно-воздушной или кислородно-закисной смесью. Является
основным методом обеспечения кардиохирургических операций, так как вызывает минимальную,
по сравнению с другими методами, депрессию миокарда. Пробуждение длительное,
требует продленной ИВЛ в послеоперационном периоде.
Нейролептаналгезия
Сочетанное использование
фентанила (аналгетик) и дроперидола (нейролептик) позволяет селективно
обеспечивать аналгезию (которая может быть усилена инсуффляцией закиси азота)
и нейровегетативное торможение. НЛА и ее модификации (атаралгезия,
комбинированная общая анестезия на основе фентанила, дроперидола, реланиума и
кетамина в различных комбинациях) получили широкое распространение в нашей
стране ввиду простоты применения и относительной дешевизны. Методики в целом
обеспечивают адекватный уровень защиты при операциях малой и средней
травматичности, однако при травматичных и длительных операциях отмечены случаи
интранаркозного пробуждения и недостаточная эффективность метода.
Тотальная
внутривенная анестезия (ТВА)
Отличается от предыдущей
исключением закиси азота, что позволяет избежать кардиодепрессивного действия
последней и «загрязнения» операционной.
Относительно новым (для нашей
страны) и прогрессивным методом ТВА является сочетанное использование дипривана
(пропофола) и фентанила. Диприван — сильный гипнотик, позволяет уменьшить
частоту интранаркозного пробуждения и добиться достаточной глубины на всех
этапах даже самых травматичных операций. Метод получил особенно широкое распространение
в хирургии «одного дня» ввиду простоты и комфортности. В настоящее время в
мире предпринимаются попытки сделать ТВА столь же управляемой, как и анестезия
парообразующими анестетиками. Для этого создаются мощные управляющие
компьютерные программы, учитывающие фармакокинетику и фармакодинамику в/в
препаратов, имеющие систему обратной связи и поддающиеся «обучению» в процессе
использования. Подобные системы получили название ТСА (Target Control Anaesthesia). Эффективность в нашей
стране не исследована.
Комбинированная общая анестезия,
основанная на сочетанном использовании парообразующего анестетика и аналгетика
Метод, который в настоящее
время пользуется в мире наибольшей популярностью. Он позволяет избежать
чрезмерного углубления анестезии (которое происходит при мононаркозе
парообразующим агентом) и в то же время обеспечивает достаточную глубину,
эффективность, управляемость и безопасность. Может быть рекомендован как
основной метод анестезиологического обеспечения оперативных вмешательств любой
степени сложности и продолжительности.
ВЕНТИЛЯЦИЯ
Общая анестезия может
проходить при сохраненном спонтанном дыхании, использовании вспомогательных
режимов ИВЛ и полном протезировании функции внешнего дыхания. Общим принципом
анестезиологии является положение о том, что собственное дыхание необходимо
сохранить в том случае и в тех объемах, в каких это возможно в рамках
выполняемой операции. Конечно, данная задача не должна становиться самоцелью и
идти в ущерб безопасности больного.
На практике это означает, что
кратковременные и малотравматичные операции, операции на конечностях могут
выполняться в условиях спонтанного дыхания.
Операции, требующие кратковременной
релаксации, могут выполняться при кратковременном выключении дыхания с проведением
ИВЛ и последующем восстановлении его с использованием вспомогательных режимов
(Pressure Support — поддержка давлением. Extended Mandatory Minute Volume — pacширенный
принудительный минутный объем). При этом проходимость дыхательных путей может
обеспечиваться использованием ларингеальной маски.
Учитывая наш опыт работы,
представляется, что ларинге-альная маска может быть использована при операциях,
проведение которых возможно в условиях сохраненного спонтанного дыхания (или
с коротким периодом ИВЛ). В противном случае необходимо проведение
интубационного наркоза.
Длительные и травматичные
операции требуют полной мио-плегии и проведения ИВЛ.
ПЕРИОД
ПРОБУЖДЕНИЯ
Является весьма важным
периодом, так как заключается в переходе от сна к бодрствованию, от временного
протезирования ряда функций к самостоятельному их функционированию и от
управляемого гомеостаза к восстановлению собственных систем его поддержания.
Период пробуждения
заканчивается экстубацией трахеи. Последняя может быть выполнена у полностью
пробудившегося пациента, пациента, находящегося в состоянии сна, но с
восстановившимися защитными рефлексами и после продленной искусственной
вентиляции легких.
Наиболее желательной является
экстубация пациента в процессе неглубокого сна (комфортность, пациент не
помнит неприятного периода «стояния» интубационной трубки) с восстановившимися
защитными рефлексами (кашлевый, ресничньш и т.д.) в операционной.
Существенно облегчает процесс
экстубации мониторинг нейромышечной проводимости.
Причины, требующие проведения экстубации
в состоянии полного пробуждения
Показания:
— полный желудок;
— пациенты, при интубации
которых были отмечены сложности;
— пациенты с предполагаемым
отеком гортани или голосовых связок;
— пациенты с операциями на
трахее или после челюстно-лицевой хирургии.
Критерии:
— пациент выполняет
простейшие команды (открыть таза, показать язык и т.д.);
— пациент в состоянии поднять
голову и пожать руку;
— эффективное спонтанное
дыхание с удовлетворительными показателями газового состава крови (выдыхаемого
воздуха, пульсоксиметрии);
— стабильность основных
показателей гемодинамики.
Техника
Пациент дышит через
ишубационную трубку 100%-ным кислородом. После аппликации лидокаина в
ингубационную трубку проводят санацию трахеи. Манжету сдувают, ингубационную
трубку извлекают. Производят санацию ротоглотки и обеспечивают поступление
100%-ного кислорода через маску наркозно-дыхательного аппарата. Постоянный мониторинг
пульсоксиметром. Убедившись в стабильности основных показателей у пациента,
его транспортируют в палату.
Экстубация
в условиях легкого медикаментозного сна
Убедившись в полном
восстановлении нейромышечной проводимости, проводят санацию трахеи.
Если сознание возвращается
раньше полного восстановления нейромышечной проводимости, допустимо введение
небольшой дозы гипнотика (диприван) или седативного препарата (мидазолам).
Экстубацию проводят по
правилам, изложенным выше, убедившись в адекватной вентиляции и стабильности
гемодинамики. Обязательна полная готовность к повторной интубации. Больной
транспортируется в палату пробуждения или палату интенсивной терапии (ПИТ) с
ингаляцией кислорода через маску.
Продленная
искусственная вентиляция легких
Продленная искусственная
вентиляция легких может использоваться как ввиду дыхательной недостаточности,
так и по специфическим показаниям. Острая дыхательная недостаточность может
быть следствием:
— основного или
инконкурентного заболевания пациента;
— депрессии дыхания из-за
кумуляции мышечных релаксантов;
— депрессивного влияния
наркотических аналгетиков. После выяснения этиологии больной транспортируется в
ПИТ на фоне продленной ИВЛ. Медицинские показания к продленной ИВЛ
— нестабильность гемодинамики
(относительное показание, экстубация может быть проведена после стабилизации
показателей);
— неврологический дефицит;
— значительная
некоррегированная или некоррегирующаяся гиповолемия.
Больной транспортируется в
ПИТ на фоне продленной ИВЛ. После определенного периода ИВЛ экстубацию
производят по критериям, принятым в интенсивной терапии.
ПЕРЕВОД
В ПИТ
Общие принципы:
— любой больной после общей
анестезии должен наблюдаться в ПИТ или палате пробуждения до полного восстановления
сознания, мышечного тонуса и адекватного спонтанного дыхания;
— перевод в ПИТ возможен
после стабилизации основных показателей гемодинамики и кислородтранспортной
функции крови;
— перевод в ПИТ больных с ASA3-5
производится под контролем пульсоксиметрии;
— анестезиолог передает пациента
под наблюдение врача ПИТ непосредственно у постели больного, сообщая все подробности
операции и анестезии.
Анестезиолог осматривает
больного после выхода последнего из критического состояния, опрашивает на
предмет качества проведенной анестезии. Ретроспективный анализ помогает понять
особенности проведенной анестезии и сделать выводы на будущее.
Рекомендуемая литература:
Guedel A.E. Ingalation Anesthesia - A Fundamental Guide.—New York, 1937.
Глава 16
ЭПИДЕМИОЛОГИЯ
АНЕСТЕЗИИ
В. В. Лихванцев
Одинаково трудно как
вычленить риск собственно анестезии из операционного риска, так и оценить риск
того или иного вмешательства у данного конкретного больного. Полезно
вспомнить, что после начала эры общей анестезии в России в 1847 г. на первые
700 наркозов не было зарегистрировано ни одной смерти, связанной с анестезией.
Ретроспективные исследования конца 50-х годов показали, что одна смерть от
анестезии регистрируется на каждые 10 000 пособий. Развитие анестезиологии
как науки, современное оборудование и введение мониторинга безопасности
позволили снизить указанный показатель до 1:50 000—1:150 000. В нашей стране
подобная статистика отсутствует, и даже не определено понятие «смерть от
анестезии». Тем не менее, по данным Н.Е. Бурова (неопубликованные данные), в
1990—1995 гг. в Москве смерть от анестезии составляла 1:100 000, что, если эти
данные справедливы, выглядит вполне терпимо.
Нет достоверной статистики и
о количестве серьезных осложнений, связанных с проведением анестезии
(осложнения со стороны ЦНС, например). Считается, что подобных осложнений
примерно на 30% больше летальности. Достаточно часто описываются такие
осложнения анестезии, как обструкция дыхательных путей, бронхоспазм,
гиповолемия, гипотония и т.д.
По-видимому, следует различать:
1. Смерть (осложнение) от
анестезии.
2. Смерть (осложнение),
возникшая в результате проведения анестезии.
3. Смерть (осложнение),
возникшая во время анестезии. К первой группе следует отнести осложнения,
которые возникли в результате действия анестезиолога (травма трахеи при
интубации, ятрогенный гидроторакс при неудачной пункции центральной вены и
т.д.).
Ко второй группе можно
отнести осложнения, которые связаны с проведением анестезии, однако их
возникновение невозможно было предупредить, они были своевременно диагностированы,
терапия была полной и адекватной. Примером может служить аллергическая реакция
на впервые введенный препарат, злокачественная гипертермия и т.д.
И, наконец, к третьей группе
следует отнести осложнения, которые прямо не связаны с проведением анестезии,
но анестезиолог вынужден принимать деятельное участие в их коррекции.
Кровопотеря является наиболее ярким примером осложнений обсуждаемой группы.
Конечно, данная классификация
достаточно условна и не исключает возникновения пограничных ситуаций. Тем не
менее она позволяет определить степень ответственности анестезиолога за
возникшее осложнение. Кроме того, первостепенное значение имеет
ретроспективный анализ действия врача при возникновении критической ситуации.
Данный анализ должен быть проведен квалифицированной комиссией из числа старших
врачей отделения и доложен на итоговой недельной конференции. Опыт показывает,
что лучший результат достигается при благожелательном (но не попустительском)
отношении членов комиссии к анестезиологу, реальном учете ими ситуации и
возможностей оперирующей бригады. Недопустимо замалчивать ошибки и промахи
анестезиолога в угоду корпоративным интересам, «честь мундира» не может служить
оправданием для уклонения от критического разбора ситуации.
Анестезиолог должен по мере
возможности предупреждать развитие нежелательных сдвигов гомеостаза пациента во
время анестезии, своевременно распознавать возникшие осложнения и принимать все
возможные меры к их устранению.
Серьезные осложнения — это, как
правило, результат нескольких ошибок: недостаток внимания (бдительности), влияние
факторов окружающей обстановки и, наконец, человеческий фактор — все это
мешает анестезиологу вовремя обнаружить проблему и принять меры к ее
устранению.
Далее суммированы наиболее
важные факторы, способствующие возникновению ошибок или препятствующие их своевременному
устранению:
1. Плохая подготовка к
проведению анестезии, включая недостаточно подробное изучение истории болезни,
недостаточную подготовку аппаратуры и оборудования.
2. Недостаточное знание
анестезиологом техники анестезии, оборудования или инструментария, тактики
хирургического вмешательства.
3. Плохие взаимоотношения
внутри хирургической (операционной) бригады.
4. Небрежность или
поспешность.
5. Затрудненный визуальный
контроль состояния больного.
6. Невнимательность или
чрезмерная усталость анестезиологической бригады.
ОБЩИЕ ПРАВИЛА БЕЗОПАСНОСТИ
Анестезиолог должен
выработать стратегию для предупреждения возможных осложнений, которая должна
состоять из:
— предоперационной
подготовки. Необходимо тщательно продумать план проведения анестезии,
подготовить рабочее место, маркировать все шприцы для введения препаратов.
Очень важна «сработанность» внутри бригады, когда врач доверяет сестре, а
последняя — врачу;
— оптимизации рабочего
места: мониторы и иное оборудование должны быть расставлены таким образом,
чтобы информация с них легко читалась, необходимо обеспечить свободный доступ
к системе обеспечения медицинскими газами;
— выбора оптимального набора
мониторируемых показателей;
— постоянной готовности к
критической ситуации и открытости для совета: лучше пригласить на помощь
раньше, чем позже.
ПРОТОКОЛЫ И СТАНДАРТЫ
В настоящее время, очевидно,
необходимо отказаться от принципа, согласно которому «каждому пациенту
необходимо проводить свой наркоз». Требования безопасности диктуют настоятельную
необходимость выработки общих подходов к предоперационной подготовке,
анестезиологическому обеспечению операции и послеоперационному наблюдению,
только тщательно сформулированные и безусловно выполняемые протоколы анестезии
в состоянии гарантировать безопасность пациента на всех этапах вмешательства.
Протоколы анестезии обязательны для выполнения всеми сотрудниками отделения и
могут изменяться
только руководителем или старшими ординаторами. Особая статья — экстренная
операция во время дежурства. Как бы то ни бьшо, любой случаи отступления
от протокола подлежит тщательному разбору с выработкой соответствующего заключения.
Протокол, в свою очередь, не должен регламентировать каждое действие
анестезиолога, он должен содержать лишь алгоритм действий в той или иной
ситуации.
Ниже приводится ряд правил,
которые являются законодательно обязательными стандартами при проведении
анестезии в США и которые взяты на вооружение сотрудниками отделения
анестезиологии Института хирургии им. АВ. Вишневского РАМН:
Правило 1. Обязательно присутствие
врача-анестезиолога на всех этапах проведения пособия; любые манипуляции.
выполняемые врачами-стажерами, медицинскими сестрами и т.д., производятся
только в присутствии врача-специалиста и с его разрешения.
Данное правило подразумевает
безоговорочную ответственность дипломированного врача-специалиста, проводящего
анестезию, за все действия бригады, связанные с проведением анестезиологического
пособия. Ни сестра-анестезистка, ни врач-стажер, ординатор и т.д., ни даже
специалист более высокой квалификации, но не работающий в данном учреждении, не
вправе вмешиваться в назначения анестезиолога, проводящего наркоз, в иной
форме, кроме рекомендательной. Анестезиолог вправе принять или отвергнуть
предложенную помощь, в любом случае за все происходящее в операционной
отвечает он один. Заведующий отделением, старшие ординаторы вправе изменить
назначение анестезиолога, проводящего анестезию, но:
— время изменения
фиксируется в наркозной карте и истории болезни;
— с этого момента
ответственность переносится на плечи человека, принявшего подобное решение.
Правило 2. Врач не имеет права
покидать операционную. При возникновении острой необходимости возможна замена
врача с фиксацией состояния больного на время замены в наркозной карте и
истории болезни.
Это правило подлежит
безусловному выполнению, так как даже при самом благоприятном течении анестезии
и видимой «безобидности» хирургического вмешательства в любую секунду может
произойти событие, которое потребует экстренных действий со стороны
анестезиолога. Ни одна самая «умная» аппаратура не в состоянии заменить анестезиолога у
операционного стола.
И вторая часть этого правила:
замена анестезиолога возможна только в исключительных случаях, так как:
— невозможно передать все
нюансы течения анестезии, сколь бы грамотными ни были оба специалиста;
— возможна отсроченная
реакция на тот или иной препарат или манипуляцию. У врача, проводившего анестезию
от начала и до конца, больше шансов установить причину происшедшего, чем у
«новеныхого».
Правило 3. Анестезиологический
персонал не должен работать более шести часов без перерыва.
Это правило введено как из
соображений защиты врача, так и больного. Если заранее известно, что операция
продлится более 6 ч, имеет смысл (чтобы не противоречить предыдущему пункту)
заранее поставить бригаду из двух врачей.
Правило 4. Врач, проводящий
анестезию, отвечает за готовность инструментария, аппаратов, оборудования и наличие
соответствующего набора медикаментов для проведения анестезии.
Это совсем не значит, что
врач должен заниматься ремонтом оборудования или приобретением
соответствующего инструментария. Данное положение означает лишь то, что врач
не имеет права проводить анестезию с неисправным оборудованием или в
отсутствие необходимого инструментария. Время начала анестезии определяет
врач-анестезиолог.
Правило 5. Врач отвечает за
соответствие выбранного мониторинга соответствующим стандартам (см. гл. «Мониторинг»).
Правило 6. Любые действия анестезиолога
(манипуляции, режимы вентиляции, введение препаратов и растворов) и основные
мониторируемые показатели гомеостаза больного фиксируются в наркозной карте.
Некоторый опыт общения с
правоохранительными органами и страховыми компаниями убедил нас в абсолютной
правоте данного требования. Кроме того, скрупулезно записанная наркозная карта
позволяет в любой момент проследить течение анестезии, проанализировать
возможные погрешности (или отметить удачные решения!) и сделать выводы на
будущее.
Правило 7. При возникновении
серьезных осложнений. параллельно с проведением интенсивной терапии, ставится в
известность руководитель отделения или лицо, его замещающее.
Как правило, руководителем
отделения назначается наиболее грамотный врач, способный своевременно помочь
правильным советом или действием. Кроме того, напряженность в хирургической
бригаде, часто возникающая во время непредвиденных осложнений, легче
разрешается в присутствии заведующего. И, наконец, руководитель отделения
имеет больше возможностей повлиять на ситуацию, так как он контролирует
положение с аппаратурой, инструментарием, медицинскими препаратами и т.д. и
способен принять оперативное решение.
ДЕЙСТВИЯ ВРАЧА-АНЕСТЕЗИОЛОГА ПРИ
ВОЗНИКНОВЕНИИ СЕРЬЕЗНОГО ОСЛОЖНЕНИЯ
При внезапной остановке
сердца больного на операционном столе или возникновении серьезного осложнения,
способного привести к летальному исходу, связанного с проведением
анестезиологического пособия, действия анестезиолога должны быть направлены на
минимизацию ущерба от осложнения и его лечение.
При этом ведущий анестезиолог
принимает на себя руководство всей операционной бригадой, в том числе
определяет, продолжать или приостановить выполнение хирургического вмешательства,
и несет полную ответственность за проводимые мероприятия. При появлении в
операционной старшего анестезиолога или руководителя отделения последний
принимает на себя ответственность за дальнейшее лечение больного, о чем обязательно
информирует бригаду и делает соответствующую запись в наркозной карте (истории
болезни), конечно же, по мере разрешения ситуации.
Анестезиолог, вовлеченный в
оказание экстренной помощи:
— выполняет распоряжения
ответственного анестезиолога;
— рекомендует ответственному
анестезиологу выполнить те или иные мероприятия или манипуляции;
— вызывает консультантов и
определяет объем их помощи;
— самостоятельно:
— не изменяет
параметров ИВЛ;
— не изменяет
настройку мониторов;
— не вводит те
или иные лекарственные препараты;
— не вмешивается
в ведение наркозной карты.
Ответственный хирург:
— останавливает операцию (по
команде анестезиолога) или по согласованию с ним предпринимает безотлагательные
меры (остановка профузного кровотечения);
— оценивает кровопотерю;
— сообщает анестезиологу собственные
клинические наблюдения.
Действия анестезиолога в
момент критической ситуации оформляются специальным протоколом, который
подписывают все члены анестезиологической бригады, включая приглашенных
помощников и руководителя отделения. Каждый случай возникновения опасного для
жизни осложнения или смерти больного на операционном столе является предметом
разбора на конференции отделения, после которой делаются выводы и принимаются
решения о правилах действия персонала в подобной ситуации.
Смерть больного или
возникновение опасного для жизни осложнения в первые часы после окончания
операции могут иметь непосредственную связь с особенностями проведения
анестезии, в этой связи клиническому разбору подлежат все подобные случаи,
произошедшие в ПИТ в первые два часа после окончания операции.
Глава 17
ВОЗМОЖНЫЕ ОСЛОЖНЕНИЯ И ИХ ТЕРАПИЯ
А.В. Ситников
ИНТРАОПЕРАЦИОННЫЙ
КОНТРОЛЬ ГЕМОДИНАМИКИ
Одной из наиболее
ответственных задач анестезиолога, особенно при обеспечении длительных и
травматичных операций, является управление гемодинамикой.
Артериальное давление —
наиболее часто мониторируемый показатель. Его величина отражает адекватность
тканевой перфузии. Физиологически более правильно было бы измерять скорость
кровотока, однако чисто технически гораздо легче измерить именно давление.
Каждый из органов в
состоянии поддерживать определенный тонус сосудов в зависимости от собственных
метаболических потребностей, подобный механизм носит название ауторегуляции.
Однако различные органы обладают неодинаковой способностью к ауторегуляции. В
наибольшей степени подобные свойства выражены у мозга, почек, сердца и легких.
Общая анестезия, как правило, угнетает ауторегуляцию органного кровотока,
делая последний (т.е. органный кровоток) полностью зависимым от системного
артериального давления.
При шоке, гиповолемии и
некоторых других состояниях возникает так называемая централизация
кровообращения. Это означает, что организм, не имея возможности обеспечить
эффективную перфузию и оксигенацию всех тканей, обеспечивает удовлетворительный
органный кровоток мозга, миокарда, легких и почек. В остальных органах
артериолы спазмируются, открываются артериовенозные шунты.
Адренергические
рецепторы
В зависимости от сродства к
естественным и синтетическим адреномимегикам все адренергические рецепторы
делятся на две группы:
— а-рецепторы —
обладают наибольшим сродством к норадреналину и далее, в порядке убывания, к
адреналину и изопротеренолу;
— В-рецепторы —
наиболее чувствительны к регуляторному эффекту изопротеренола и только затем
адреналина и норадреналина.
Рецепторы, взаимодействующие
преимущественно с допамином, называют допаминергическими.
Кроме того, в зависимости от
локализации и фармакологии рецепторы могут быть далее подразделены на:
а-адренорецепторы
— а1-рецепторы расположены на
постсинаптической мембране гладкой мускулатуры сосудов, коронарных артерий,
матки, кожи, слизистой тонкого кишечника. Активация приводит к повышению
тонуса соответствующего артериального и венозного колена и расслаблению
гладкой мускулатуры кишечника. Стимуляция постсинаптических а1-рецепторов
миокарда повышает инотропизм и вызывает брадикардию;
— пресинаптические а2-рецепторы расположены в ЦНС. Активация
вызывает угнетение освобождения адреналина и симпатической активности, что
приводит к гипотонии и брадикардии;
— постсинаптические а2-рецепторы расположены как в гладкой
мускулатуре сосудов, так и ЦНС. Стимуляция рецепторов сосудов приводит к
развитию вазоконстрикции и гипертензии, рецепторов ЦНС — к аналгезии.
В-адренорецепторы
— В1-рецепторы расположены в миокарде,
синоатриальном узле, проводящей системе сердца, жировой ткани. Стимуляция
приводит к положительному инотропному, хронотропному эффектам, облегчению
проведения по проводящим путям сердца, липолизу;
— В2-рецепторы
расположены в гладкой мускулатуре сосудов, бронхов и матки. Стимуляция
вызывает вазодилатацию, бронходилатацию и расслабление матки. Кроме того,
ускоряется глюконеогенез, происходит гиперпродукция инсулина и облегчается
транспорт калия внутрь клеток.
Допаминергические
рецепторы
Допаминергические-1-рецепторы располагаются
постсинаптически в гладкой мускулатуре артерий почек и внутренних органов, их
стимуляция приводит к вазодилатации.
Допаминергические-2-рецепторы расположены пресинаптически
и опосредуют угнетение освобождения норадреналина.
Между количеством рецепторов
и циркулирующими в крови медиаторами существует обратная взаимосвязь. Так, при
резкой отмене р-блокаторов после длительной терапии может развиться гипертензия
и тахикардия — как результат увеличения числа В-рецепторов и их
повышенной чувствительности к эндогенному адреналину.
Фармакология
адренергических препаратов
Селективные а1-агонисты
в настоящее время практически не используются.
В-агонисты
Изопротеренол является В-адренергическим
агонистом прямого действия. Препарат вызывает увеличение ЧСС и сократимости
миокарда при снижении ОПС. Кроме того, изопротеренол является эффективным
бронходилататором и уменьшает общелегочное сопротивление (ОЛС).
Показания:
— гемодинамически значимая и
устойчивая к действию атропина брадикардия;
— легочная гипертензия и
правожелудочковая недостаточность;
— а.-в. блокада при
невозможности немедленной имплантации электрода и проведения
электрокардиостимуляции;
— низкий сердечный выброс,
требующий коррекции за счет увеличения ЧСС (дети, имеющие фиксированный ударный
объем, реципиент с пересаженным сердцем);
— астматический статус;
— передозировка В-блокаторов.
Рекомендуется в/в введение (0,4 мг болюсно; 0,15 мкг/
кг/мин в виде инфузии до достижения желаемого эффекта). Необходим постоянный
ЭКГ-конгроль.
Побочные эффекты: вазоплегия, гипотония и
тахиаритмии.
Смешанные агонисты
Адреналин — является смешанным а- и
р-агонистом прямого действия, вырабатывается в мозговом слое надпочечников.
Показания:
— остановка сердца;
— анафилактическая реакция;
— бронхоспазм;
— кардиогенный шок;
— массивное кровотечение;
— пролонгирование регионарной
анестезии.
Клинический эффект адреналина
(20—100 мкг болюсно при гипотонии; 0,5—1 мг болюсно при остановке сердца; 0,5—
4 мкг/мин в виде постоянной инфузии) складывается из суммации эффектов от стимуляции ос-
и р-рецепторов. При введении в низких дозах превалирует В-стимулирующий
эффект. Адреналин в любых дозах увеличивает сократимость миокарда и ЧСС. В
низких дозах адреналин вызывает расслабление гладкой мускулатуры бронхов,
вазодилатацию, увеличение сердечного выброса и тахикардию. По мере увеличения
дозы начинает преобладать а-адреностимулирующий эффект препарата, и
сердечный выброс может уменьшиться в результате существенного увеличения
постнагрузки (ОПС).
Значительная тахикардия,
аригмогенный эффект и адреналин-зависимая ишемия существенно ограничивают
клиническое использование препарата. Следует помнить, что ингаляционные
анестетики, особенно галотан, сенсибилизируют миокард к аритмогенному действию
адреналина, вплоть до фибрилляции желудочков. Адреналин следует вводить в
центральную циркуляцию. Попадание раствора под кожу может привести к некрозу
тканей.
Норадреналин (НА) (1—30 мкг/мин капельно)
является медиатором симпатической нервной системы. НА — смешанный а- и В-агонист,
в низких дозах превалирует альфа-опосредованный эффект; по сравнению с
адреналином — значительно менее выражено стимулирующее влияние на а-рецепторы.
НА вызывает увеличение как АДсис, так и АДдиа, сердечный выброс при этом либо
не меняется, либо уменьшается параллельно с увеличением ОПС. Препарат показан
при гипотонии на фоне удовлетворительного сердечного выброса.
Допамин (1—20 мкг/(кг/мин) —
является предшественником НА и в зависимости от дозы вызывает стимуляцию преимущественна
а-, В- или допаминергических рецепторов. В дозах < 4
мкг/кг/мин допамин стимулирует рецепторы сосудов почек и внутренних органов,
наблюдается увеличение почечного кровотока и стимуляция диуреза. С увеличением дозы растет
выраженность В-опосредованного эффекта, наблюдается тахикардия,
увеличение сократимости миокарда, артериального давления. В дозах более 10—12
мкг/кг/мин начинает сказываться а1-эффект препарата — резко
увеличивается артериальное и венозное давление, уменьшается почечный кровоток.
Обычно допамин используют для терапии олигурии при синдроме низкого сердечного
выброса. Терапия допамином показана также при шоке, сопровождающемся депрессией
миокарда. Тахикардия, глубокая вазоконстрикция и увеличение потребления кислородом
миокарда, связанные с его введением, ограничивают применение препарата.
Добутамин (2—30 мкг/кг/мин) —
синтетический катехоламин, способный связываться с высоким сродством с В1, В2- и а1-адренергическими
рецепторами. Добутамин увеличивает сократимость миокарда благодаря связи с а1-
и В1-рецепторами. В то же время препарат является периферическим
вазодилататором, так как В1-эффект превышает влияние на а1-рецегггоры.
Добутамин может вызывать невыраженную тахикардию. Добутамин является весьма
эффективным препаратом для терапии синдрома низкого выброса, возникшего как
следствие острого инфаркта миокарда, кардиомиопатии или сердечной недостаточности
в кардиохирургии.
Гемодинамический эффект
добутамина напоминает таковой при применении комбинации допамина и
нитропруссида: наблюдается увеличение сердечного выброса с уменьшением ОПС и
минимальное влияние на АД и ЧСС. Добутамин вызывает и уменьшение ОЛС, что
делает препарат незаменимым при лечении правожелудочковой недостаточности.
Среди возможных побочных эффектов нельзя не отметить гипотензию (добутамин —
инотропный препарат, но не вазопрессор), увеличение потребления кислорода
миокардом и возможность появления аритмий.
Эфедрин (5—10 мг болюс) —
некатехоламинный алколоид со свойствами адреноагониста. Эфедрин вызывает выброс
НА и других эндогенных катехоламинов из депо в нервных терминалях. Обладает
слабым прямым стимулирующим влиянием на а- и В-адренергические
рецепторы. Используется для терапии гипотонии при проведении регионарной
анестезии, передозировке общих анестетиков, гиповолемии, брадикардии. Резко
выражена тахифилаксия.
Неадренергические
симпатомиметики
Амринон и милринон
ингибируют фосфодиэстеразу-III, что приводит к увеличению
внутриклеточного пула цАМФ, результирующегося в увеличении сократимости
миокарда и периферической вазоплегии. Эффект данных препаратов не связан с
активацией адренорецепторов, и потому они могут использоваться совместно с
адреномиметиками.
Амринон (0,75мг/кг болюс, затем
5—10 мкг/кг/мин) вызывает дозазависимое увеличение сердечного индекса, индекса
ударной работы желудочков и фракции выброса без значимых изменений ЧСС и АД.
Время наступления эффекта — 5 мин, продолжительность действия 10—12 ч. Побочные
эффекты редки и не выражены, заключаются в умеренной гипотонии,
тромбоцитопении, дисфункции желудочно-кишечного тракта.
Милринон — является производным
амринона с тем же гемодинамическим профилем. Милринон в 20 раз эффективнее амринона
и обладает менее выраженными побочными эффектами.
ЗАКЛАДКА
В-блокаторы
Пропранолол (обзидан, индерал)
Пропранодол (0,5—1,0 мг
болюсно) — неселективный антагонист со сродством к В1- и В2-адренергическим
рецепторам. Он является прототипом для всех остальных препаратов данного
класса и эталоном для сравнения активности. Препарат элиминируеся в печени и
период полувыведения составляет 3— 4 ч. Гемодинамические эффекты пропранолола и
других В-блокаторов связаны с уменьшением сердечного выброса и
ингибирующим влиянием на ангиотензин-рениновую систему, В-блокаторы
следует различать по их относительному сродству к В1-адренергическим
рецепторам, симпатомиметической активности и периоду полувыведения.
Эсмолол (бревиблок)
Эсмолол является селективньм
В1-антагонистом. Рекомендуемая доза 10—20 мг болюсно;
насыщающая доза — 0,25— 0,5 мг/кг; поддерживающая — 50—200 мкг/(кг/мин). Метаболизм
эсмолола связан с ферментативной деградацией препарата в цитоплазме эритроцитов
под воздействием эстеразы. Время от введения до наступления пика активности
примерно 5 мин. Период полувыведения 9 мин. Эсмолол — наиболее популярный препарат для
интраоперационного применения, так как и действие наступает и происходит
элиминация достаточно быстро; он может применяться у пациентов с бронхиальной
астмой, обструктивными заболеваниями легких и скомпрометированным миокардом.
Следует помнить, что быстрое болюсное введение эсмолола может привести к
депрессии миокарда, гипотонии и даже остановке сердца.
Вазодилататоры
Нитропруссид Nа
Нитропруссид
— вазодилататор прямого действия с одинаковой активностью на гладкую мускулатуру
артерий и вен.
Механизм действия нитропруссида является общим
и для всех нитратов. Нитропруссид разлагается с освобождением нестабильной,
короткоживущей молекулы NO, которая является
активатором гуанилатциклазы. Образующийся цГМФ является медиатором мышечной
релаксации.
Гемодинамический эффект нигропруссида складьшается
из снижения постнагрузки за счет артериальной вазоплегии и некоторого
уменьшения преднагрузки за счет повышения емкости венозной системы. Это в свою
очередь, как правило, приводит к увеличению ЧСС, сократимости миокарда и,
следовательно, сердечного выброса, а также снижению ОПС и ОЛС. Нитропруссид
вызывает дилатацию сосудов мозга и потому с осторожностью должен
использоваться у пациентов с повышенным внутричерепным давлением.
Нитропруссид вызывает
расширение сосудов всех регионов, повышает степень внутриорганного
шунтирования крови, и при его применении может возникать синдром обкрадывания.
Так, например, ишемизированный участок, сосуды которого максимально расширены,
начинает получать меньше крови, так как происходит ее перераспределение в
соседние участки, сосуды которых еще способны расширяться. Это особенно опасно
у пациентов с коронарной недостаточностью еще и потому, что под влиянием
нитропруссида за счет снижения постнагрузки уменьшается перфузионное давление.
Нитропруссид может
использоваться интраоперационно, так как эффект наступает быстро (1—2 мин), и
продолжается недолго (2 мин после прекращения инфузии). Рекомендуемая доза —
0,1 мкг/(кг/мин) с постепенным увеличением до наступления эффекта.
Водный раствор нитропруссида
подвержен фотодеградации с образованием неактивных компонентов, цианид-ион при
этом не освобождается. In vivo Нитропруссид вступает в
неферментативное взаимодействие с сульфгидрильными группами гемоглобина и
образует пять радикалов цианида на одну молекулу. В тканях и преимущественно в
печени происходит образование тиоцианата, который выводится с мочой. Период
полувыведения тиоцианата — 4 ч, соединение может накапливаться в организме,
особенно при почечной недостаточности. Цианид связывается с митохондриальной
цитохромоксидазой и нарушает процесс тканевого дыхания, что может привести к
гипоксии клеток в условиях нормального транспорта кислорода.
Клиника интоксикации
цианидом.
Ранними признаками интоксикации являются тахифилаксия, метаболический ацидоз и
увеличение насьпцения кислородом смешанной венозной крови. Подобная картина
наблюдается при концентрации цианида в крови более 10 мкг/л, что соответствует
введению препарата со скоростью 1мг/кг в течение 2,5 ч. Симптомы интоксикации
цианидами могут включать также тошноту, мышечный спазм, ишемические боли,
нарушения сознания.
Лечение интоксикации. Терапия интоксикации цианидами
заключается в немедленном прекращении инфузии, ингаляции (инсуфляции) 100% кислорода
и введении тиосульфата Na. Последний, растворенный в
50 мл воды, вводится в дозе 150 мг/кг, медленно, в/в в течение 15 мин.
Нитроглицерин
Нитроглицерин является
преимущественно венозным вазодилататором, однако вызывает также расслабление
гладкой мускулатуры артерий, легочной артерии, мочеточников, матки,
желудочно-кишечного тракта, бронхов. Преобладающее влияние нитроглицерина на
емкость венозного русла предопределяет основной механизм гипотензивного
эффекта препарата за счет снижения венозного возврата крови.
Показания. Нитроглицерин показан для
терапии сердечной недостаточности и ишемии миокарда для увеличения коронарного
кровотока и улучшения работы левого желудочка. Нитроглицерин увеличивает
емкость сосудистого русла, уменьшает преднагрузку и конечно-диастолический
объем желудочков. В соответствии с законом Лапласа:
сила сокращения = давление •
радиус,
уменьшение
конечно-диастолического давления сопровождается уменьшением давления и размера
(радиуса), что, в свою очередь, приводит к уменьшению напряжения стенки желудочка
и уменьшению потребления кислорода миокардом.
Тахикардия является частым побочным
эффектом при применении нитроглицерина, она нивелирует эффект препарата, так
как приводит к увеличению потребления кислорода миокардом и потому нуждается в
коррекции. Рекомендуется использование В-блокаторов.
При продолженной инфузии
довольно быстро развивается толерантность, и для достижения необходимого
эффекта необходимо увеличение дозы препарата.
Осложнения. Метаболизм нитроглицерина
протекает в печени, токсические эффекты препарата при использовании в терапевтических
дозах не описаны. Использование нитроглицерина в слишком высоких дозах и
слишком продолжительное время может привести к образованию метагемоглобина. Нитроглицерин
вызывает расширение сосудов мозга и потому с осторожностью должен
использоваться у лиц с повышенным внутричерепным давлением.
Рекомендуется использование
в виде постоянной инфузии с начальной скоростью 0,1 мкг/кг/мин. Начальная доза,
вводимая болюсно, — 50—100 мкг.
Блокаторы кальциевых каналов
Кальциевые блокаторы
угнетают транспорт ионов кальция через мембрану и вызывают расширение артерий
без влияния на емкость венозного звена сосудистого русла. Они вызывают
уменьшение ОПС и увеличивают коронарный кровоток. Препараты данной группы
являются также миокардиодепрессантами и угнетают внутрисердечное проведение.
Верапамил является производным
папаверина и может быть препаратом выбора для лечения суправентрикулярной
тахиаритмии. Он эффективен для контроля частоты сокращения желудочков,
предупреждения и лечения фибрилляции и трепетания предсердий в том случае,
если нет дополнительных патологических путей проведения (синдром
Вольф—Паркинсон—Уайта); рекомендуемая доза — 5—10 мг в/в болюсно. Верапамил
является мощным миокародиодепрессантом и должен с осторожностью использоваться
у пациентов с гипотонией или левожелудочковой недостаточностью.
Дилтизем — селективный коронаролитик
с минимальным влиянием на проводимость сердца и тонус периферических артерий.
Он вызывает умеренное уменьшение ЧСС и практически не влияет на сократимость
миокарда. Дилтизем является наиболее популярным блокатором кальциевых каналов
для терапии хронической коронарной недостаточности.
Нифидипин является одновременно
коронаролитиком и периферическим вазодилататором. Действие на сократимость и
проводимость миокарда не выражено. Не существует формы для в/в применения,
может применяться per os или «под язык».
Аденозин препятствует выбросу
норадреналина и используется в клинике для создания управляемой гипотонии.
Препарат расширяет сосуды мозга, угнетает ауторегуляцию сосудистого тонуса. В
организме быстро претерпевает превращение с образованием мочевой кислоты.
Учитывая мягкий угнетающий эффект на внутрисердечную проводимость ранее использовался
для терапии суправентрикулярных тахиаригмий, включая синдром
Вольф—Паркинсон—Уайта. 6 мг аденозина вводится в/в под контролем ЭКГ. Возможно
повторное введение (12 мг максимум). После короткого периода асистолии
(<1мин) происходит восстановление синусового ритма.
Гипотензия
Гипотензия — это
существенное снижение артериального давления ниже уровня, обычного для данного
пациента. Гипотензия может возникать вследствие нарушений сократимости
миокарда, снижения преднагрузки (ЦВД или ДЗ) или постнагрузки (ОПС) левого
желудочка.
Сократимость
— все ингаляционные
анестетики (галотан, энфлюран, изофлюран) являются кардиодепрессантами. Опиаты
проявляют кардиодепрессивный эффект только при использовании в высоких дозах
(центральная аналгезия);
— большинство препаратов,
используемых для терапии (ИБС), являются кардиодепрессантами: пропранолол,
верапамил и их производные, лидокаин;
— кроме того, нарушения сократимости могут быть связаны с инфарктом миокарда, гипотермией (температура тела ниже 33°С), гипокальциемией, ацидозом или алкалозом, раздражением блуждающего нерва (например, ларинго-кардиальный рефлекс во время интубации трахеи на фоне поверхностной анестезии), токсическим эффектом большой дозы местных анестетиков (лидокаин, новокаин и т.д.).
|
|
Снижение преднагрузки (неадекватный венозный
возврат)
— гиповолемия может быть
результатом кровопотери, неадекватного восполнения интраоперационных потерь
жидкости, полиурии, надпочечниковой недостаточности;
— сдавление полых вен — в
результате заболеваний, манипуляций хирургов или беременности;
— увеличение емкости
венозного русла — вследствие симпатической блокады (регионарная анестезия),
действия лекарственных препаратов (нитроглицерин, барбитураты, пропофол);
— увеличение давления в
правом предсердии — вентиляция большими объемами с использованием PEEP или
в результате ряда заболеваний: поражения клапанного аппарата сердца, легочная
гипертензия, пневмоторакс, тампонада сердца.
Снижение постнагрузки
— изофлюран, в меньшей
степени галотан и энфлюран, уменьшают ОПС;
— опиаты практически не
влияют на ОПС, за исключением морфина, который благодаря гистаминогенному
эффекту может уменьшать ОПС;
— большие дозы
бензодиазепинов, особенно при совместном применении с опиатами, могут вызвать
существенное снижение ОПС;
— может возникнуть как
составная часть симптомокомплекса при аллергическом шоке;
— септический шок часто
сопровождается гипотонией;
— может возникнуть в
результате симпатической блокады при проведении эпидуральной или спинальной
анестезии;
— «турникетный шок» — реваскуляризация
участков тела после снятия турникета с магистрального артериального сосуда
может привести к вымыванию в кровь биологически активных веществ —
вазодилататоров;
— многие лекарственные
препараты вызывают снижение ОПС: вазодилататоры (нитропруссид, нитроглицерин); а-адреноблокаторы
(дроперидол); препараты, способствующие гиперпродукции гистамина (тубарин);
ганглиоблокаторы (пентамин); клофелин; блокаторы кальциевых каналов
(нифедипин).
Аритмии
— тахисистолия приводит к
гипотонии — вследствие сокращения времени диастолического заполнения
желудочков;
— фибрилляция и трепетание
предсердий, узловой ритм могут приводить к развитию гипотонии — вследствие
отсутствия «предсердной надбавки» — крови, поступающей в желудочки в
результате своевременного сокращения предсердий. Предсердная надбавка
составляет до 30% конечно-диастолического объема желудочков;
— брадиаритмии — могут
приводить к развитию гипотонии, если преднагрузка недостаточна для компенсации
за счет увеличения ударного объема.
Лечение должно быть направлено на
коррекцию причины, приведшей к развитию гипотонии, и может заключаться в:
— уменьшении глубины
анестезии;
— восполнении объема;
— использовании
вазопрессоров;
— устранении причины
пневмоторакса, уменьшении PEEP и т.д.;
— лечении аритмии и ишемии
миокарда;
— использовании атропина (или
его производных) для предупреждения вагусных рефлексов или кардиостимулятора
при брадикардии или внутрисердечной блокаде.
Гипертензия
Этиология. Причиной интраоперационной
гипертензии может бьпъ:
— выброс катехоламинов — как
следствие недостаточной глубины анестезии (особенно при интубации трахеи,
стернотомии, лапаротомии и других травматичных этапах операции), гипоксия,
гиперкапния, боль при регионарной анестезии, длительное стояние турникетов;
— сопутствующие заболевания —
гипертоническая болезнь;
— повышенное внутричерепное
давление;
— пережатие аорты;
— гипертензия вследствие
внезапной отмены гипотензивных препаратов (клофелина, В-блокаторов и
т.д.);
— гипертензия — вследствие
одновременного назначения несовместимых лекарственных препаратов, например
антидепрессантов иди ингибиторов моноаминооксидазы одновременно с эфедрином;
— гиперволемия.
Лечение заключается в устранении
причины, приведшей к развитию гипертензии, и может включать:
— коррекцию параметров ИВЛ;
— углубление анестезии;
— медикаментозную терапию:
— назначение В-антагонистов,
например пропранолол (обзидан) — 0,5—1 мг в/в;
— назначение
вазодилататоров, например:
— нитроглицерина — в виде
в/в инфузии с начальной скоростью 20 мкг/мин и постепенным увеличением дозы до
наступления ожидаемого эффекта;
— нитропруссида Na с
начальной скоростью 20 мкг/мин и постепенным увеличением дозы до наступления
ожидаемого эффекта;
— тропафена в дозе 1 мг/мин
с постепенным увеличением дозы до наступления ожидаемого эффекта;
ИНТРАОПЕРАЦИОННЫЕ НАРУШЕНИЯ ЖИЗНЕННО
ВАЖНЫХ ФУНКЦИЙ
Гиперкапния
Неадекватная вентиляция
— Угнетение дыхания в
результате действия наркотиков, барбитуратов, бензодиазепинов, парообразующих
анестетиков (при спонтанной вентиляции).
— Нарушение нейромышечной
проводимости может возникнуть при проведении высокой спинномозговой или
эпидуральной анестезии, недостаточной декураризации (при спонтанном дыхании).
— Неправильно выбранные
параметры ИВЛ.
— Высокое сопротивление в
дыхательных путях вследствие бронхоспазма или уменьшения легочного комплайнса.
— Обструкция верхних
дыхательных путей, сердечная недостаточность, гемо-, гидро-, пневмоторакс.
— Рециркуляция СО2
в контуре вследствие выработки ресурса адсорбера, поломки клапанов вдоха или
выдоха, недостаточной подачи «свежей» газонаркотической смеси.
— Патология ЦНС (опухоль, ишемия, отек) может привести к неэффективной вентиляции.
Увеличение образования СО2 происходит при поступлении
углекислого газа извне (всасывание из брюшной полости при лапароскопических
операциях), проведении полного парентерального питания, повышенном метаболизме
(злокачественная гипертермия), серьезных нарушениях кислотно-основного
состояния.
Лечение
— при возникновении центральной депрессии дыхания после премедикации может понадобиться различная помощь: от попыток «растормошить» больного до проведения вспомогательной вентиляции мешком «амбу» через маску или же интубационную трубку;
— при неадекватной
вентиляции;
— при проведении ИВЛ —
коррекция параметров;
— при спонтанной вентиляции
— уменьшение концентрации летучих анестетиков или уменьшение доз в/в
препаратов;
— повышенное сопротивление в
дыхательных путях. Бронхиальная астма, инородное тело или раздражение
слизистой трахеи интубационной трубкой может привести к развитию бронхоспазма.
Необходимо:
— убедиться в правильном
положении интубационной трубки;
— удалить инородное тело,
кровь, гной, жидкость и провести полную санацию трахеобронхиального дерева;
— произвести ингаляцию
симпатомиметиков (изадрин) или ввести преднизолон, эуфиллин и т.д. При
рециркуляция СО2 в контуре необходимо:
— заполнить адсорбер свежей
натронной известью;
— убедиться в правильной
работе клапанов;
— увеличить поток «свежей»
газонаркотической смеси. При увеличении продукции СО2 необходимо
диагносцировать и лечить:
— злокачественную
гипертермию;
— сепсис — введение
антибиотиков и увеличение частоты дыхания;
— снятие турникета с аорты и
т.д. — необходимо временное увеличение параметров ИВЛ.
Эмболия
легочной артерии
Эмболией легочной артерии
называют нарушение кровообращения в бассейне легочной артерии в результате
попадания тромба, возбуха, жира или амниотической жидкости.
Факторы риска:
— гиперкоагуляция;
— тромбофлебит вен нижних
конечностей, таза;
— беременность;
— травма (особенно с повреждением
длинных трубчатых костей);
— рак;
—гиподинамия.
Клиника
Специфических признаков
эмболии нет. Наблюдаются тахикардия, тахипноэ, гипотония, гипоксия.
Инструментальные признаки:
— инфаркт легкого при
рентгенографии;
— P-pulmonale, смещение электрической оси
сердца вправо, изменения зубца Т на ЭКГ;
— гипоксия и гипокапния при
анализе газового состава крови;
— окончательный диагноз
ставится на основании ангиопульмонографии.
Терапия:
— терапия гипоксии всеми
доступными методами;
— борьба с гипотонией;
— введение гепарина (дробно
по 5 000 ЕД каждые 4 ч);
— тромболитическая терапия
(стрептокиназа и т.д.) часто затруднена из-за опасности массивной кровопотери;
— в критической ситуации,
как операция отчаяния, — тромбэктомия в условиях общего искусственного
кровообращения.
Тампонада
сердца
Тампонадой называют
скопление крови или другой жидкости в перикарде, в результате чего резко
уменьшается венозный возврат и ударный объем сердца.
Тампонада сердца возникает
при:
— операциях на органах
грудной полости и сердце;
— травмах;
— перикардитах различной
этиологии;
— перфорации миокарда при
катетеризации вен, проведении внутрисердечных исследований и манипуляция
(катетерная баллонная вальвулопластика и т.д.),
Клиника
Тахикардия, выбухание
яремных вен, приглушенность тонов сердца, уменьшение пульсового давления.
Одновременное увеличение ЦВД и давления заклинивания легочных капилляров. На
рентгенограмме — равномерное расширение границ сердца. Особенно информативна
эхокардиография.
Лечение
Единственный способ лечения
— перикадиоцентез.
Гипотермия
Частая проблема
интраоперационного периода, особенно при длительных и травматичных
вмешательствах. Потери тепла происходят:
— с поверхности кожи (до 60%
общих потерь), зависят от уровня периферического кровотока и площади
поверхности тела;
— с дыханием (до 20%),
зависят от относительной влажности вдыхаемого газа;
— в результате
соприкосновения с более холодными предметами (до 5%);
— в результате конвекции (до
15%) и зависят от работы кондиционера в операционной: чем чаще смена воздуха в
операционной, тем больше потери.
Дети и пожилые пациенты
больше подвержены охлаждению и особенно чувствительны к изменению температуры.
Некоторые препараты,
используемые во время анестезии, увеличивают потери тепла:
— летучие анестетики —
вследствие улучшения периферического кровотока;
— наркотики и дроперидол —
вследствие угнетающего влияния на центр терморегуляции.
Интраоперационная гипотермия опасна, так как:
— вызывает увеличение общего
периферического сопротивления, депрессию миокарда, появление аритмий;
— вызывает увеличение
общелегочного сопротивления и угнетает механизм защитной активной
вазоконстрикции;
— увеличивает вязкость
крови, вызывает сдвиг кривой диссоциации оксигемоглобина влево;
— уменьшает мозговой
кровоток, увеличивает сопротивление в артериях мозга, снижает МАК, но в то же
время позволяет несколько продлить время интенсивной терапии и реанимации при
возникновении тяжелых осложнений;
— уменьшение органного
кровотока в печени и почках приводит к снижению скорости элиминации препаратов,
используемых для анестезии и, таким образом, уменьшает их расход;
— дрожь может увеличить
теплообразование на 100—300%. При этом потребление кислорода увеличивается на
400—500%, увеличивается также образование СО2;
— приводит к олигурии
вследствие снижения органного кровотока в почках.
Предупреждение и лечение
гипотермии
— поддержание температуры
комфорта в операционной (не ниже 21°С);
— лекарственные растворы и
кровь необходимо переливать только после предварительного согревания;
— согревание больного
(водяной или электрический матрац, обкладывание грелками и т.д.);
— использование
увлажнителей, лучше — сухих увлажнителей, совмещенных с абактериальным
фильтром;
— использование
полузакрытого контура и низкопоточной техники.
Гипертермия
Состояние, при котором
температура увеличивается более чем на 2°С в час. Как исключение может быть
следствием слишком усердных попыток согреть больного в операционной.
Гипертермия и сопровождающее ее увеличение уровня метаболизма, в свою очередь,
приводят к увеличению потребления кислорода, работы миокарда, метаболическому
ацидозу и компенсаторной гипервентиляции. Наблюдаемая вазоплегия приводит к
относительной гиповолемии и снижению венозного возврата крови. При температуре
более 42°С может наступить повреждение ЦНС.
Причины:
— злокачественная
Гипертермия;
— повышенный уровень
метаболизма — характерен для сепсиса, инфекционного заболевания,
тиреотоксикоза, феохромоцитомы и может быть следствием реакции на растворы для
инфузии;
— повреждение центра
терморегуляции, находящегося в гипоталамусе, при отеке, травме, опухоли,
абсцессе мозга;
— гипертермический синдром
вследствие блокады центра терморегуляции нейролепгиками (дроперидол)
встречается крайне редко;
— терапия
симпатомиметиками.
Терапия
Выраженную гипертермию можно
лечить обкладыванием больного грелками со льдом, укутыванием во влажные простыни, растиранием спиртом.
Повысить теплопотери можно использованием вазодилататоров: нитропруссида и
нитроглицерина. При подозрении на злокачественную гипертермию следует
немедленно ввести дантролен.
Злокачественная
гипертермия
Гиперметаболический синдром,
возникающий из-за нарушения повторного захвата саркоплазматическим ретикулумом
ионов кальция, необходимого для окончания мышечного сокращения. Патогенез до
конца не выяснен. Предполагается, что провоцирующим фактором может быть
использование препаратов сукцинилхолинового ряда и галогенсодержащих
анестетиков.
В отечественной литературе не
содержится описания ни одного клинического наблюдения.
Клиника
— лихорадка;
— необъяснимая тахикардия;
— гиперкапния;
— ацидоз;
— ригидность мышц, несмотря
на применение мышечных релаксантов (считается, что если на введение
сукцинилхолина возникла мышечная регидность, то следует ждать развития злокачественной
гипертермии);
— гипоксемия;
— миогемоглобинурия;
— гиперкалиемия;
— большая разница в
концентрации СО2 в смешанной венозной и артериальной крови
подтверждает диагноз злокачественной гипертермии.
Лечение
1. Немедленное прекращение
подачи анестетиков, операция должна быть закончена в максимально короткий срок.
Необходима смена наркозного аппарата.
2. Введение дантролена в
начальной дозе 2,5 мг/кг в/в и до 10 мг/кг всего. Дантролен — единственный
известный препарат, замедляющий высвобождение кальция из саркоплазматического
ретикулума. Каждая ампула дантролена содержит 20 мг дантролена и 3 г маннитола,
которые должны быть разведены в 50 мл воды для инъекций.
3. Симптоматическая терапия,
борьба с гипертермией, ацидозом, аритмией, олигурией и т.д.
Анафилактические
и анафилактоидные реакции
Анафилаксия инициируется взаимодействием
антигена с иммуноглобулином Е (IgE) на наружной мембране моноцитов
и базофилов, что приводит к освобождению фармакологически активных субстанций:
гистамина, простагландинов, кининов и т.д.
Анафилактоидные реакции клинически очень похожи на
анафилаксию, однако не требуют IgE как медиатора и не связаны с предыдущей
сенсибилизацией.
Клиника
— появление кожных высыпаний;
— бронхоспазм или отек
верхних дыхательных путей;
— гипотония и шок, связанный
с периферическим коллапсом и резким увеличением крови, депонированной в
капиллярном русле;
— отек легких.
Лечение
— при коллапсе — прекращение
подачи анестетика;
— переход на инсуфляцию 100%
кислорода;
— терапия гипотонии солевыми
или коллоидными растворами;
— введение адреналина;
— введение стероидных
гормонов;
— введение антигистаминных
препаратов.
Глава 18
ИНТРАОПЕРАЦНОННАЯ
ИНФУЗИОННО-ТРАНСФУЗИОННАЯ
ТЕРАПИЯ
А.В. Ситников
Задачи интраоперационной
инфузионно-трансфузионной терапии:
— поддержание адекватного
объема циркулирующей крови;
— поддержание эффективного
уровня транспорта кислорода;
— поддержание оптимального
коллоидно-осмотического давления крови;
— коррекция
кислотно-основного состояния крови (КОС). При оперативных вмешательствах, не
связанных со значимыми потерями крови, основная задача инфузионной терапии —
возмещение интраоперационных потерь жидкости и коррекция КОС. Средний темп
инфузии при операциях подобного типа должен составлять 5—8 мл/(кг/ч). В начале
операции и не реже одного раза каждые четыре часа проводится исследование
газового состава и КОС крови.
ПОКАЗАНИЯ К
ТРАНСФУЗИОННОЙ ТЕРАПИИ
Трансфузия компонентов крови
показана, если снижено образование, ускорено разрушение, нарушена функция или
имеется потеря специфических компонентов крови (эритроцитов, тромбоцитов) или
факторов свертывания крови.
Анемия
Гематокрит. Основным показанием для
трансфузии эритроцитов является стремление поддержать эффективный уровень транспорта
кислорода тканям. Здоровые люди или пациенты с хронической анемией, как
правило, легко переносят снижение Ht (гематокрит) до 20%—25% при
нормальном объеме циркулирующей жидкости. Считается обязательным поддерживать более
высокий уровень Ht у пациентов с коронарной недостаточностью или
окк-люзирующими заболеваниями периферических сосудов, хотя эффективность
данного положения никем не доказана.
При возникновении анемии в
интраоперационном периоде необходимо выяснить ее этиологию; она может быть
следствием недостаточного образования (железодефицитная анемия), кровопотери
или ускореного разрушения (гемолиз).
Единственным показанием к
гемотрансфузии
является анемия.
Как правило, учет
кровопотери производят по количеству использованных салфеток, количеству крови
в банке для отсоса и т.д.
Можно оценить объем
кровопотери (ОК) и используя следующую формулу:
OK =
(Htисходный — Htтикущий) • ОЦК / Htисходный
где Htисходный — значение Ht при
поступлении больного в операционную;
Нtтекущий — значение Ht на момент
исследования;
ОЦК— объем циркулирующей крови
(примерно 7% массы тела).
Количество крови, которое
необходимо перелить для достижения желаемого уровня Ht (HtЖ), можно рассчитать по
формуле:
объем трансфузии =
= (Htж
— Htисходный) • ОЦК / Htкрови
для трансфузии
Тромбоцитопения
Спонтанного кровотечения
можно ожидать при снижении количества тромбоцитов менее 20 000, однако для
интраоперационного периода желательно иметь не менее 50 000 тромбоцитов.
Тромбоцитопения также может
быть следствием уменьшения образования (химиотерапия, опухоль, алкоголизм) или
повышенного разрушения (тромбоцитопеническая пурпура, гиперспленизм, терапия
специфическими препаратами (гепарин, Н2-блокаторы) тромбоцитов.
Может возникать вторично вследствие развития синдрома массивных
гемотрансфузий.
Коагулопатия
Диагноз коагулопатического
кровотечения должен быть основан на результатах исследования свертывающей
системы крови.
Время кровотечения — время до начала
образования сгустка крови. Технически это выглядит следующим образом: несколько
капель крови пациента помещают на стекло и постоянно перемешивают стеклянной
палочкой. Фиксируют время появления первого сгустка. Более точным является
исследование in vivo: при раздутой манжетке
производят стандартный разрез (5 мм длиной и 2 мм глубиной) на тыльной
поверхности кисти руки. Фиксируют время начала образования сгустка.
Увеличение времени
кровотечения — интегративный показатель состояния свертывающей системы крови.
В норме составляет 5—7 мин.
Активированное время
свертывания
(АВС) является модификацией предыдущего метода. В норме АВС составляет 90—130
сек. Наиболее удобный тест для проведения в операционной гепаринотерапии
(искусственное кровообращение, например, необходимо проводить при АВС не менее
500 сек).
При подозрении на болезнь
свертывающей системы крови необходимо проведение развернутого коагулогического
исследования.
ТЕРАПИЯ
КОМПОНЕНТАМИ КРОВИ
Общие показания к терапии
теми или иными компонентами крови суммированы в табл. 18.1.
Трансфузия 250 мл
эритроцитарной массы (с Ht около 70%) повышает Ht взрослого пациента на 2—3%.
Некоторые
замечания по поводу гемотрансфузии
Нельзя переливать кровь
одновременно с глюкозой (гемолиз) или растворором Рингера-лактата (содержит
ионы кальция, возможно образование микросгустков).
При гемотрансфузии
целесообразно использовать фильтры с диаметром 40 мк (например, Pall,
США) для предупреждения попадания микроагрегатов в кровеносное русло.
Показания к трансфузии
|
Препарат |
Состав |
Показания |
|
Цельная кровь |
Эритроциты, лейкоциты, тромбоциты, плазма |
Острая кровопотеря (одновременная потеря крови и
плазмы; следует помнить, что через 72 ч лейкоциты теряют свою активность),
дефицит факторов свертывания VII и VIII |
|
Эритрощтгарная масса |
Эритроциты, лейкоциты, тромбоциты, минимум плазмы |
Анемия любой этиологии |
|
Концентрированные тромбоциты |
Тромбоциты (обогощенные), эритроциты, лейкоциты,
плазма |
Тромбоцитопения, тромбоцитопатия |
|
Свежезамороженная плазма |
Плазма со всеми факторами свертывания, без
тромбоцитов |
Коагулопатия |
|
Криоприципитат |
Фибриноген, факторы VIII и XIII |
Дефицит соответствующих факторов свертывания |
|
Плазма лиофилизированная |
Частично денатурированные белки |
Гипопротеинемия, гиповолемия |
Плазмозаменители
Помимо широко известных в
нашей стране полиглюкина, реополиглюкина и желатиноля, которые обладают целым
рядом побочных эффектов, для коррекции гиповолемии целесообразно использовать:
— альбумин (изотонический — 5%, или
гипертонические 10- и 20%-ные растворы) является пастеризованной плазмой;
уменьшается риск развития инфузионных и трансфузионных осложнений; период
полувьшедения — 10—15 дней;
— декстран 70 (Макродекс) и
декстран 40 (Реомакродекс), равно полиглюкин и реополиглюкин, — являются высокомолекулярными
полисахаридами. Макродекс, как более высокомолекулярный препарат, не
фильтруется в почках; оба препарата претерпевают ферментативную и
неферментативную биодеградацию организме; период полувыведения — 2—8 ч;
декстраны уменьшают адгезивные свойства тромбоцитов и вызывают угнетение
активности VIII фактора свертывания; гипокоагуляция, как правило,
наблюдается после введения декстранов в дозе не менее 1,5 г/кг; анафилактоидные
реакции наблюдаются у примерно 1% пациентов (при использовании поли- и
реополиглюкина — значительно чаще);
— HAES-steril
— коллоидный плазмозаменитель, он увеличивает объем плазмы, тем самым улучшая
показатели сердечного выброса и транспорта кислорода. В результате этого
HAES-steriI улучшает деятельность внутренних органов и общую картину
гемодинамики у больных с гиповолемией и шоком. 6%-ный HAES-steriI используется
для нерасширенного, средней продолжительности, восполнения объема в рутинной
хирургической практике. Поскольку по эффективности 6%-ный HAES-steriI близок к
5%-ному человеческому альбумину и свежезамороженной плазме, его применение при
гиповолемии и шоке существенно сокращает потребность в альбумине и плазме.
10%-ный HAES-steriI используется для расширенного, средней продолжительности,
восполнения объема также у больных с гиповолемией и шоком, если ставится задача
более быстрого и массивного увеличения объема и более мощного воздействия на
гемодинамику, микроциркуляцию и доставку кислорода. В качестве примеров можно
назвать находящихся в отделениях реанимации больных с массивной острой
кровопотерей, хирургических больных с продолжительным шоком, нарушениями
микроциркуляции и/или повышенным риском тромбоэмболии легочной артерии (ТЛА).
10%-ный HAES-steril также существенно экономит альбумин у больных с
гиповолемией/шоком. Восполнение объема при крово/плазмопотере.
ОСЛОЖНЕНИЯ
ГЕМОТРАНСФУЗИИ
1. Реакции на переливание
крови
Гемолиз. Гемолиз наблюдается с
частотой примерно 1/30 000 наблюдений и связан в основном с дефектами приготовления
препаратов крови. Симптомы: головная боль, боль в области шеи, возбуждение,
повышение температуры. У пациентов, находящихся в условиях общей анестезии, лихорадка,
необъяснимая кровоточивость, гемогтобинурия, гипотония.
При возникновении подозрения
на гемолиз необходимо:
— немедленно прекратить
трансфузию;
— послать пробы крови донора
и реципиента в лабораторию для проведения теста на индивидуальную совместимость
(повторно проверить групповую совместимость);
— исследовать кровь пациента
на содержание свободного гемоглобина (более 200 мг% - гемолиз);
— терапия гипотонии (инфузия
плазмозаменителей, введение вазопрессоров);
— введение кортикостероидов;
— профилактика и
терапия почечной недостаточности.
Негемолитические реакции чаще всего связаны с возникновением
аллергических реакций. Симптомы: повышение температуры, гипотония, тахикардия,
сыпь. Необходима терапия кортикостероидами и антигистаминными препаратами.
2. Нарушение КОС крови
Гиперкалиемия возникает особенно часто
при переливании эритроцитарной массы длительных сроков хранения (гемолиз
«старых» эритроцитов сопровождается освобождением ионов К+. Как
правило, в специфической терапии не нуждается.
Гипокальциемия. Цитрат, используемый для
консервирования крови, связывает ионы кальция. Как правило, клинически
значимой гипокальциемии не возникает, так как цитрат быстро разлагается в
печени. В некоторых случаях — печеночная недостаточность, быстрая массивная
гемотрансфузия — необходимо дополнительное введение хлорида (глюконата)
кальция.
Ацидоз. Консервированная кровь
имеет слабо кислую реакцию из-за наличия кислых продуктов метаболизма клеток
крови. Клинического значения не имеет, специфической терапии не требует.
Алкалоз может возникнуть при
быстрой массивной гемотрансфузии, так как вследствие деградации одной молекулы цитрата образуются три
молекулы бикарбоната. Коррегируется изменением параметров ИВЛ.
3. Инфекционные осложнения
Следует помнить, что при
проведении гемотрансфузии возможно заражение реципиента различными
инфекционными заболеваниями (гепатит В, С; СПИД и т.д.). Для предупреждения
необходим тщательный отбор доноров.
ПРИНЦИПЫ
ИНФУЗИОННОЙ ТЕРАПИИ
При решении проблемы
коррекции интраоперационной кровопотери накоплен достаточно большой опыт и
выработаны обоснованные рекомендации по действиям анестезиолога в условиях
внезапной кровопотери (Риккер К., 1987; Рябов Г.А. с соавт., 1983):
— инфузия крови и (или)
эритроцитарной массы до нормализации уровня Ht;
— инфузия растворов коллоидов
и кристаллоидов в соотношении 1:3 до нормализации ЦВД или ДЗ (давления заклинивания
легочных капилляров);
— коррекция КОС.
Stephenson et al. (1988) считает, что риск
летального исхода увеличивается на 5 % с каждой единицей (250 мл) перелитой
крови. И хотя с этим трудно согласиться, отрицательное влияние массивных
трансфузий донорской крови не вызывает сомнений.
В этой связи понятно
стремление исследователей к возможному снижению кровопотери и инфузии крови
для ее коррекции. Многие авторы предлагают воздерживаться от переливания
донорской крови (А.У. Лекманов с соавт., 1995; Мухин В.Х. с соавт., 1981; Ryan et al., 1989) или же проводить
умеренную гемодилюцию (Кузнецов Н.А. с соавт., 1990; Меерсон Ф.3., 1981;
Полуэктов с соавт., 1995; Сухоруков В.П., с соавт., 1995; Sejoume et al., 1989).
Разработан и применяется ряд
программ ИТТ. Они включают использование солевых и коллоидных
кровезаменителей, обеспечивающих нормализацию центральной гемодинамики и ликвидацию
циркуляторной гипоксии, а также переливание крови с целью восстановления
кислородтранспортной функции крови и компенсации гемической гипоксии.
В. Хартиг (1982) острую
кровопотерю у взрослых (до 1,5 л) предлагает возмещать не содержащими эритроциты
коллоидными растворами, при этом гематокрит (Ht) не должен быть ниже 25—27%,
кровопотерю в 1,5—3 л — коллоидньми растворами и кровью в соотношении 1:2, при
потере более 3 л — коллоидными растворами и кровью в соотношении 1:1. То есть
при острой кровопотере количество переливаемых коллоидных растворов, не
содержащих эритроциты, должно составлять около 1/3 объема кровопотери (но не
более 1,5 л) с учетом гематокрита; при потребностях более этого количества
применяется кровь.
Самостоятельное применение электролитных
растворов для восполнения объема принципиально возможно, но их количество
должно быть в 2—4 раза больше потерянного объема. Однако они остаются в
кровеносном русле очень недолго. Хартиг отмечает положительное влияние
гемодилюции на микроциркуляцию (уменьшение вязкости).
Подобная тактика,
по-видимому, оправданна в экстренной анестезиологии, у больных с неясным
объемом предстоящей кровопотери. В то же время заведомо известный высокий объем
предстоящей кровопотери заставляет искать иные пути поддержания оптимального
ОЦК.
Общие
принципы:
— инфузионная терапия
проводится под контролем ЛАДдиа (8—12 мм Hg) или ЦВД (10—12 мм Hg);
— темп, объем и качественный
состав инфузионной терапии меняется в зависимости от этапа операции;
— кровь или эритроцитарная
масса (отмытые эритроциты) переливаются в зависимости от уровня НЬ (Ht), а не
величины кровопотери. На заключительном этапе операции НЬ не должен быть ниже
90—100 г/л;
— соотношение коллоидных и
кристаллоидных растворов поддерживают на уровне 1:3; 1:4;
— при кровопотере свыше 1000
мл показано использование аппаратов быстрого возврата крови.
Таблица 18.2
|
Величина кровопо-тери |
Объем кровопотери |
Объем гемотрансфузии |
Общин объем инфуэии |
||||
|
л |
% ОЦК |
л |
% кровопотери |
колл., л |
крист., л |
всего.л |
|
|
Умеренная |
До 1,0 |
До 20 |
— |
— |
До 0,6 |
До 1.0 |
1,6 |
|
Тяжелая |
1,5—3 |
25—40 |
0,8—1,2 |
30—50 |
1,0—1,5 |
1,5—2,0 |
3,3—4,7 |
|
Массивная |
Более 3 |
Более 40 |
Не менее 1.2 |
30—60 |
1,5—2,0 |
Не менее 2,5 |
Не менее 5,2 |
Темп
инфузии
В начале операции темп инфузии высокий, необходимо добиться гиперволемической гемодилюции в объеме 160—170% должного ОЦК. Это позволяет поддерживать основные показатели гемодинамики на стабильных цифрах без существенного влияния на кислородтранспортную функцию крови.
При выполнении основного
этапа операции темп инфузии определяется величиной кровопотери и уровнем ЦВД
(ЛАДдиа).
Качественный
состав инфузионных сред
После выполнения основного
этапа изменяется качественный состав инфузионных сред за счет увеличения
удельного веса плазмы и плазмозамещающих растворов. Соотношение коллоидов и
кристаллоидов на данном этапе 1:2. Из плазмозамещающих растворов предпочтение
отдается семейству HAES, Fresenius, Германия.
Более перспективным
представляется использование гемаклеточной системы «cellsaver» — аппаратов быстрого
возврата крови. В подобных аппаратах используется мембранный фильтр для
удаления большей части белковых и плазменных загрязнений. Они позволяют
осуществлять высокоэффективное разделение жидких и клеточных элементов при
малом давлении. Однако и данный метод имеет ряд ограничений: не всегда
возможно собрать хотя бы большую часть изливающейся крови, необходим
определенный промежуток времени для процесса сбора и отмывания эритроцитов и
т.д.
Рекомендуемая литература:
Кузнецов Н.А., Аксенова Т.Н.,
Тихомиров А.Н., Рогуленко Р.В. Механизмы гемодинамических сдвигов при
нормоволемической гемодилюции//Анестезиология и реаниматология.—1990.—№
5.—С.20—22.
Лекманов А.У, Бецис О.М.,
Мухидинов Ш.М. Влияние инфузионной гемодилюции на состояние гемодинамики и
кислородного транспорта при урологических операциях у детей //Анестезиология и
реаниматология.—1995.—№ 1.—С. 45—48.
Меерсон Ф.3. Адаптация, стресс и
профилактика.—М., 1981.
Мухин В.Х., Вишневская М.А.,
Асланян Р.Л. и
др. Материалы II Всероссийского съезда анестезиологов и
реаниматологов.— Красноярск, 1981—Т 2—С. 194—196.
Полуэктов Л.В., Рудаков В.А.,
Салюков Ю.Л.
с соавт. Анестезиологическое и реанимационное обеспечение многоэтапных операций
и обширных резекций печени // Материалы 3-й конференции
хирургов-гепатологов.—СПб., 1995.—С. 130—132.
Рябов Г.А. с соавт. Экстренная
анестезиология.—М., 1983.
Сухоруков В.П. с соавт. Анализ летальности
и пути ее снижения при резекциях печени большого объема // Материалы 3-й
конференции хирургов-гепатологов.—СПб., 1995.—С. 142—143.
Хартиг В. Современная инфузионная
терапия. Парентеральное питание.—М.: Медицина, 1982.
Ryan J.A. et al. Liver resection without blood
transfusion. // Am-J-Suig—1989—V. 157 (5).—P. 472-75.
Sejonrne P. et al. Effect of
haemodilution on transfusion requirement in liver
resection.//Lancet.—1989.—Dec. 9, 2 (8676).—Р. 380—382.
Stephenson K.R. et al. Perioperative blood
transfusions, associated with decreased time to reccurrence and decreased
survival after resection of colorectal liver metastases.//Ann-Surg.—1988.—V. 208 (6).— P.
679—687.
Глава 19
МОНИТОРИНГ
ГЛУБИНЫ ОБЩЕЙ АНЕСТЕЗИИ
В.Л. Виноградов
Первой и
основной задачей анестезиолога является обеспечение эффективного и адекватного
уровня анестезии на всех этапах выполнения оперативного вмешательства. Понятие
адекватности анестезии включает в себя как необходимые компоненты:
эффективное обезболивание — мы должны гарантировать
больному отсутствие любых болевых ощущений, связанных с проведением анестезии и
операции;
амнезию — пациент не должен
«присутствовать на собственной операции», т.е. не должен помнить ничего,
связанного с оперативным вмешательством;
нейовегетативное торможение — об эффективности которого
в первом приближении принято судить по косвенньш признакам: отсутствие реакции
АД, ЧСС и т.д.
Миоплегия, управление
гемодинамикой и другие компоненты общей анестезии определяют качество
анестезии, но не влияют на ее глубину.
На начальных этапах развития
анестезиологии все компоненты общей анестезии достигались применением одного
какого-либо наркотического агента. Однако это требовало применения значительных
доз общего анестетика и довольно глубокого угнетения жизненно важных структур
организма. Такая анестезия, безусловно, была связана с большим риском для
больного.
В современных условиях, когда
используется более прогрессивный метод наркоза — общая комбинированная
анестезия, при котором сон, аналгезия, мышечная релаксация, нейровегетативная
блокада и т.д. селективно обеспечиваются применением различных препаратов, —
проблема контроля глубины наркоза становится еще более необходимой. Хотя
следует признать, что в настоящее время вопрос о передозировке анестетиков и,
как следствие, неоправданно опасной глубине наркоза не стоит так остро, как в
эпоху мононаркоза. Более актуальной становится проблема неоправданно
поверхностного наркоза. Анестезиолог порой лишен возможности решить вопрос о
достаточности анестезии, чтобы предотвратить наличие сознания и ощущение боли
у больного, так как в условиях комбинированного обезболивания ни один из
существующих методов контроля глубины анестезии не является полностью
надежным.
Сообщения о случаях
неадекватной глубины анестезии начали появляться одновременно с публикациями о
первых опытах операций под наркозом.
В 1959 г. Cheek D.B. предположил, что больной
даже при глубокой анестезии способен слышать происходящее вокруг на
подсознательном уровне, но обычно пациенты не могут вспомнить произошедшего во
время операции. Однако интраоперационный период можно воспроизвести в состоянии
гипноза. Такую возможность продемонстрировал в 1965 г. Levinson B.W. Ему удалось заставить
больных, не имевших во время операции явных признаков сознания, вспомнить ход
операции под гипнозом.
В настоящее время признается,
что сознание сохраняется при наличии или отсутствии последующей памяти на
события даже на фоне вполне адекватной, как мы полагаем, анестезии.
По литературным данным,
частота случаев сохранения сознания во время операций колеблется от 0 до 4% и
имеет место даже при «хорошо проводимых анестезиях». Однако при применении
техники гипноза удается восстановить слуховые воспоминания о ходе операции у
20—30% пациентов. Этому могут способствовать следующие предпосылки:
— легкая ингаляционная
анестезия;
— тотальная внутривенная
анестезия;
— неполадки аппаратуры;
— ожирение;
— хронический алкоголизм или
лекарственная зависимость;
— гиповенгиляция;
— высокая концентрация
кислорода;
— ошибки медицинского
персонала.
Также повышают риск
интраоперационного пробуждения и определенные клинические ситуации. Считается,
что чаще сохранение сознания наблюдается при операциях в кардиологии,
акушерстве, экстренной травматологии и у детей.
Проблема пробуждения во время
операции остается не только большой этической и теоретической проблемой. Наличие
сознания и
боли во время операции может иметь далеко идущие последствия для
физиологического состояния больного, так как неадекватная анестезия в лучшем
случае вызывает неприятные ощущения у пациента, а в худшем приводит к развитию
шока той или иной степени выраженности и срыву всей стройной системы
адаптационных механизмов, что обусловливает в итоге нарушения органного и
системного характера и, конечно же, отрицательно сказывается на течении
послеоперационного периода и результатах хирургического лечения в целом.
Сознательное воспоминание травматических моментов операции можно подавить, но
сопутствующие им эмоции не угнетаются и способствуют проявлению тревоги и
депрессии в последующем. «Невидимые шрамы операции» — так называет их Cheek D.B. И упреком анестезиологам
служит исследование, выполненное Moermann N. с соавт. (1992),
показавшее, что четверть из 678 человек, перенесших операции под общим
обезболиванием, по той или иной причине не удовлетворены качеством проведенного
наркоза.
КОНЦЕПЦИЯ МОНИТОРИНГА ГЛУБИНЫ АНЕСТЕЗИИ
Несмотря на внешнюю простоту,
на самом деле очень трудно ответить на вопрос о том, как определить и наблюдать
за губиной анестезии, так как отсутствие сознания, аналгезия, релаксация — это
величины типа «все или ничего». Наблюдая за пациентом, анестезиолог должен
решить для себя ряд проблем типа: если у пациента возникает двигательная
реакция в ответ на хирургическую манипуляцию, то как это можно расценивать —
как побочный эффект или неадекватную анестезию? Если глубина анестезии была
достаточна в предоперационном периоде, то может ли хирургическая агрессия
изменить ее?
Таким образом, глубина
анестезии — это категория, зависящая не только от эффекта лекарственного
вещества и его концентрации, но и от афферентной импульсации. Такой подход
осложняет мониторинг глубины анестезии, так как, будучи зависимым от различных
условий, уровень анестезии будет ступенчато изменяться. Поскольку интенсивность
хирургических стимулов непредсказуема, то современный подход к этой проблеме
означает определение заранее возможного ответа со стороны организма и
дозированного введения анестетиков в зависимости от предполагаемой
травматизации. В идеале для определения глубины наркоза следовало бы нанести
больному четко определяемый и строго дозированный стимул и отметить эффект. На
практике таким стимулом часто является кожный разрез. Однако он количественно
не верифицируется, зависит от человека, степени травматизации и от многих
других причин. К тому же проводится он однократно. Поэтому изучаются и
предлагаются другие разновидности неинвазивной стимуляции, которые могли бы
дозироваться и наноситься неоднократно. Проблема, ассоциирующаяся с измерением
глубины анестезии, осложняется и отсутствием универсальных определений глубины
наркоза, которые должны быть предельно понятны и выражены клинической
терминологией.
МЕТОДЫ КОНТРОЛЯ ГЛУБИНЫ АНЕСТЕЗИИ
Общеклинические
Со времен внедрения во
врачебную практику эфира и хлороформа ориентиром для определения глубины
анестезии служила клиника. В 1847 г. John Snow был
первым, кто предпринял попытку классифицировать стадии наркоза. Основываясь на
изменениях в характере дыхания, сознания, произвольных и непроизвольных
движениях мускулатуры, ресничном рефлексе, Show выделил пять уровней
эфирного наркоза.
В 1937 г. Guedel A.E. ввел свою классификацию
признаков, характеризующих определенные стадии общей анестезии, которые стали
«золотым стандартом», определяющим ведение анестезиологического пособия.
Исследуя такие клинические признаки, как уровень сознания, мышечный тонус,
спонтанное дыхание, влажность кожных покровов, реакцию зрачков на боль,
движение глазных яблок, наличие или отсутствие глотательного и рвотного
рефлексов, Guedel выделил четыре стадии общей анестезии: I стадия —
аналгезия, II стадия — возбуждение, III стадия (стадия хирургической
анестезии) была разделена на четыре уровня, к IV стадии автор отнес дыхательный
паралич и смерть.
В дальнейшем многие
исследователи пытались модифицировать эту классификацию. Детализации и
обработке подвергались первые три стадии, осталась незыблемой лишь IV стадия.
Во всех схемах она считается токсической, заканчивающейся смертью больного.
Однако И.С. Жоров в 1959 г. в своей классификации заменил IV стадию, как
«стадию интоксикации и смерти», на «период пробуждения» больного, справедливо
отмечая, что «...смерть в связи с наркозом может произойти и в начальных его
стадиях, еще до начала операции. ... Отсутствие стадии пробуждения делает
незавершенными все существующие классификации и не дает полного представления
о течении наркоза от его начала до конца». По-видимому, как это часто бывает,
каждый из приведенных авторов прав по-своему.
1940 год ознаменовался
началом применения в клинической практике мышечных релаксантов. Начиная с
применения малых доз d-тубокурарина для индуцирования 2—3 уровня III
стадии наркоза по Guedel на фоне высоких концентраций ингаляционных
анестетиков, анестезиологи очень быстро перешли на применение высоких доз
миорелаксантов в сочетании с ИВЛ, несколько снизив при этом концентрацию вдыхаемых
анестетиков, так как это существенно снижало риск кардиоваскулярных и
респираторных осложнений. С появлением миорелаксантов и ИВЛ непроизвольные
мышечные движения перестали быть показателями глубины анестезии.
В настоящее время
использование клинических признаков для контроля наркоза основано на том, что
анестезия и сенсорная активация являются антагонистами. При этом следует помнить,
что клиническая картина ответа может меняться под влиянием параллельно
вводимых препаратов (вазодилататоров, B-адреноблокаторов,
транквилизаторов и т.д.) и зависеть от индивидуальных особенностей организма.
Подобные недостатки не исключают использования показателей центральной и
периферической гемодинамики (ЦиПГ), которые отражают эффективность сенсорной
защиты. Однако мониторинг ЧСС, АД, МОС, ЛАД, ФП, наиболее частая комбинация,
используемая в настоящее время в клинике, при всей своей ценности имеет известные
ограничения информативности, обладает определенной инерционностью и не всегда
легко и правильно интерпретируется. «Классический» вариант реакции ЦиПГ (т.е.
одновременное увеличение ЧСС, АД, МОС, ЛАД, ОПС и т.д.) характерен только для
начальных этапов длительных и травматичных операций. В условиях же массивной
кровопотери и интенсивной инфузионно-трансфузионной терапии (ИТТ) эта реакция
определяется темпом кровопотери, характером ИТТ, а не эффективностью проводимой
анестезии. На данном этапе нередки случаи неоправданно поверхностной
анестезии.
Исследование некоторых показателей
метаболизма
Мониторинг параметров КОС и
кислородно-транспортной функции крови (КТФк), а также динамики гормонов — «индикаторов
стресса», по-видимому, может служить наиболее точным отражением адекватности
обезболивания. Однако экспресс-методов определения этих показателей, способных
работать в режиме on line, пока не разработано.
Концепция
минимальной альвеолярной концентрации (МАК)
Определенным шагом на пути
создания новых методов контроля глубины анестезии явилась разработка Eger E.I. в 1965 г. концепции о
минимальной альвеолярной концентрации ингаляционного анестетика (МАК).
Полностью концепция была сформирована к концу 80-х годов.
МАК — это минимальная
концентрация ингаляционного анестетика в альвеолярном газе, предотвращающая
двигательную реакцию на стандартный болевой раздражитель (разрез кожи или
электрический импульс) у 50% пациентов. В настоящее время получены значения МАК
для всех ингаляционных анестетиков (табл. 19.1). МАК-концепция четко
продемонстрировала, что необходимая для предотвращения двигательных реакций
концентрация анестетиков должна быть выше, чем для выключения сознания или
проводниковой чувствительности.
Используемые в анестезии
медикаменты снижают МАК, чем оправдывается их применение с целью уменьшения
дозы основного анестетика. Например, закись азота уменьшает МАК всех
использующихся в настоящее время анестетиков (табл. 19.1). Величина МАК
является весьма надежным количественным критерием действия анестетика, и эта
концепция оказалась важным шагом на пути разработки методов контроля глубины
анестезии, установив взаимосвязь между дозой анестетика и его эффектом.
Вместе с тем теория
альвеолярных концентраций не лишена серьезных недостатков:
— концентрация анестетиков в
выдыхаемом газе не всегда отражает его концентрацию в артериальной крови;
— МАК дает представление лишь
об одной точке кривой «доза — эффект». Попытка сравнения эффекта двух
анестетиков при 1,5 и 2 МАК не всегда правомерна, так как кривые «доза —
эффект» могут быть не параллельны;
— не у всех анестетиков
существует линейная зависимость между наркотическим и аналгетическим эффектом;
— расчет МАК применим лишь в
случае проведения анестезии ингаляционными анестетиками.
Минимальная альвеолярная концентрация (МАК) для
различных газовых анестетиков (Barash P.
et al., 1992)
|
Анестетик |
МАК (об %) |
МАК (об %) при 60—70 % N2O |
|
Закись азота |
104 |
— |
|
Галотан |
0,77 |
0,29 |
|
Энфлюран |
1,70 |
0,60 |
|
Изофлюран |
1,15 |
0,50 |
|
Севофлюран |
1,71 |
0,66 |
|
Десфлюран |
6,0 |
2,83 |
Дополнительные
методы
В качестве возможных
дополнительных способов оценки глубины анестезии рядом исследователей изучались
и изучаются методы, позволяющие на основании анализа косвенных показателей
оценить эффективность проводимого обезболивания. К числу последних относятся:
— электромиография лобных
мышц;
— мониторинг спонтанной и
спровоцированной сократительной активности нижнего отдела пищевода;
— анализ фотоплетизмограммы;
— метод «изолированного
предплечья»;
— анализ респираторной
синусовой аритмии;
— поглощение O2 и продукция СО2;
— математический анализ ритма
сердца;
— периферическая и центральная
термометрия и др. Эти показатели также изменяются в зависимости от глубины
анестезии, но они не нашли широкого применения в анестезиологии или при
дальнейшем изучении выявилась их недостаточная информативность. Однако мы
позволим себе рассмотреть некоторые из них, отмечая оригинальность подхода в
попытке решения обсуждаемой проблемы.
Метод
«изолированного предплечья»
Техника метода заключается в
наложении турникета на плечо больного еще до введения миорелаксантов. Таким
образом, сохраняется нейромышечная передача ниже уровня наложения турникета.
Наблюдая за появлением движения в «изолированном предплечье» в ответ на
речевые команды или хирургическую стимуляцию, можно судить об уровне
проводимой анестезии. Методика не получила широкого применения из-за опасности
развития ишемии в конечности.
Электромиография
лобной мышцы
Мониторинг глубины анестезии
при помощи электромиографии лобной мышцы возможен из-за особенностей иннервации
ее за счет висцеральных волокон лицевого нерва и веточек тройничного нерва,
оставляющих «окно» для изучения вегетативной нервной системы. Таким образом,
даже в условиях тотальной миоплегии лобные мышцы сохраняют возможность
реагировать сокращением на хирургическую агрессию. Этот феномен, получивший
название «симптом нахмуривания бровей», лег в основу ряда анестезиологических
мониторов, например АВМ, DATEX, Финляндия. Paloheimo M. (1989), один из энтузиастов этого метода,
сообщает, что неадекватная анестезия или пробуждение в конце операции всегда
сопровождается изменением в амплитуде фронтальной ЭМГ, хотя это часто очевидно
и по данным других методов мониторинга. Виккерс M. (1991) также высказывает
сомнение в абсолютной достоверности этого метода, так как по характеру кривой
ЭМГ нельзя ничего сказать относительно сознания больного.
Мониторинг спонтанной и спровоцированной
сократительной активности нижнего отдела пищевода
Нижний отдел пищевода
включает в себя гладкую мускулатуру, на которую мышечные релаксанты не
оказывают влияния. Он получает основную иннервацию из блуждающего нерва с
наличием механизмов центрального контроля в стволе мозга.
Частота и амплитуда
сокращений регистрируются с помощью введенного зонда с баллончиком.
Исследования показали, что при отсутствии побочных факторов, таких, как
применение ганглиоблокаторов, атропина или проведения эпидуральной анестезии на
уровне грудного отдела, с уменьшением дозировки анестетика увеличиваются
частота спонтанных и амплитуда спровоцированных сокращений. Складывается
впечатление, что подобный мониторинг имеет перспективы для первичной оценки
глубины анестезии, когда применяются ингаляционные анестетики. Его
эффективность при использовании различных внутривенных анестетиков находится в
стадии изучения.
Вариационная
пульсометрия
В настоящее время известно
несколько десятков методов анализа сердечного ритма.
Отправной точкой является
числовая последовательность значения R—R-интервалов. В этой последовательности содержится информация о
процессах, протекающих не в самом сердце, а различных звеньях системы
управления вегетативным гомеостазом, поэтому изучение вариабельности ритма
сердца позволяет вьмснить степень выраженности адаптационных процессов в
организме в ответ на то или иное стрессовое воздействие.
Ряд исследователей отмечают,
что между изменениями функции сердечно-сосудистой и симпатоадреналовой систем,
наступающих в ходе операции и анестезии, наблюдается высокая корреляционная
зависимость.
Однако наряду с сообщениями
об успешном применении вариационной пульсометрии для оценки выраженности
операционного стресса в литературе имеются работы, в которых использование
этого метода привело к получению неинтерпретируемых данных. Это обусловлено
наличием «аномальных R—R-интервалов, соответствующих
нарушениям проводимости сердца, так как даже сравнительно небольшое их число
приводит при расчетах к весьма значительным отклонениям от реальных величин.
Поэтому этот вид мониторинга неприменим у больных с постоянными формами
нарушения ритма.
Снижает ценность и
оперативность метода необходимость набора определенного числа кардиоинтервалов,
уменьшение которого ведет к возрастанию степени ошибки при вычислении, а
увеличение нерационально из соображений оперативности получения данных.
Нейрофизиологические
методы контроля
ЦНС — главная мишень для
анестетиков. Поэтому следует признать, что наиболее точным и информативным бьш
бы прямой контроль деятельности ЦНС как интегративной системы реагирования на
неэффективность анестезиологической защиты. Современные методы мониторинга
неврологических функций пытаются уйти от недостатков, связанных с применением
клинических признаков. При этом используют оценку спонтанной и вызванной
ЭЭГ-активности.
Электроэнцефалография
Частотный спектр ЭЭГ
простирается от 0,5 до 100 Гц, хотя большая часть его мощности (99%)
сконцентрирована в диапазоне от 1 до 30 Гц. При визуальном анализе ЭЭГ
выглядит как сложный апериодический волновой процесс. Появление сигналов
флуктуирует в течение дня и циклически меняется в ходе сна. Существует 4—5
основных классов ЭЭГ-частот. Они были установлены на основе применения первых
инструментальных методов и находятся в следующих пределах: (0,5—3 Гц), (4—7 Гц), a
(8—13 Гц), β1 (14—17 Гц) и β2 (свыше 18 Гц).
Переход от
состояния бодрствования ко сну, применение лекарств, некоторые патологические
состояния сопровождаются изменениями ЭЭГ (табл. 19.2).
Впервые изменение картины ЭЭГ
во время индукции в анестезию описал Gibbs F.A. в 1937
г. В дальнейшем исследования по определению стадий общей анестезии на основе
ЭЭГ бьши проведены для: эфира, циклопропана, метоксифлурана и барбигуратов.
Внутривенные и ингаляционные
анестетики неодинаково влияют на ЭЭГ, и их эквипотенциальные концентрации
продуцируют сильно различающиеся ЭЭГ-частоты (табл. 19.3). Тем не менее
всеобщее правило изменения картины ЭЭГ под их действием, предложенное Faulconer A.J. и Bickford R.G.
(1990), которое проявляется как «замедление частоты и первоначальный подъем,
за которым следует снижение амплитуды ЭЭГ в зависимости от клинического
диапазона глубины анестезии», может быть применено для большинства используемых
сегодня анестетиков.
Изменения ЭЭГ, наступающие
при введении некоторых лекарственных препаратов и патологических состояниях (Barash P. et al..
1992)
|
Характеристика ЭЭГ |
Медицинские препараты и состояния гомеостаза |
|
Возрастание частоты |
Барбитураты (малые дозы) Бензодиазепины (малые дозы) Этомидат (малые дозы) Закись азота (30—70%) Ингаляционные анестетики (< 1 МАК) Калипсол Артериальная гипоксемия (легкая) Гиперкапния (средняя) Эпилептический припадок |
|
Снижение частоты/ повышение амплитуды |
Барбитураты (умеренные дозы) Этомидат (умеренные дозы) Опиаты Ингаляционные анестетики (1 МАК) Артериальная гипоксемия (средняя) Гиперкапния (от умеренной до тяжелой) Гипотермия |
|
Снижение частоты/ снижение амплитуды |
Барбитураты (высокие дозы) Артериальная гипоксемия (средняя) Гиперкапния (тяжелая) Гипотермия (< 35° С) |
|
Изоэлектрическая линия (электрическое молчание) |
Барбитуратовая кома Этомидат (высокие дозы) Изофлюран (2 МАК) Артериальная гипоксемия (тяжелая) Гипотермия (< 20° С) Смерть мозга |
Последующие достижения в
автоматизированной обработке ЭЭГ позволили дополнить визуальный анализ ЭЭГ
частотным и периодиограммным, облегчающими и ускоряющими количественную оценку
изменений частотно-амплитудных характеристик ЭЭГ. Хотя Mori К.
(1993) считает, что применение обрабатывающих устройств не позволяет извлечь
дополнительную информацию, заключенную в первичной ЭЭГ, и обученный персонал
может получить больше информации из необработанной ЭЭГ, чем из прошедшей
обработку.
ЭЭГ-частоты, продуцируемые различными анестетиками в эквипотенциальных концентрациях
|
Анестетик |
ЭЭГ-частота (Гц),
соответствующая хирургическому уровню анестезии |
|
Фторотан |
6 |
|
Энфлюран |
7—12 |
|
Изофлюран |
4—8 |
|
Тиопентал |
1—3 |
Принцип работы, использующийся
в устройствах для обработки ЭЭГ, — это трансформация осцилляций ЭЭГ на основе
анализа Fourier в цифровые, выделяемые по их частотному компоненту.
К основным, наиболее распространенным, методам количественной оценки ЭЭГ
относится частота края спектра (spectral edge frequency — SEF). В зависимости от взятого
частотного диапазона SEF подразделяют на SEF-95, SEF-90, SEF-50.
Например, SEF-95
определяется вычислением отношения мощности взятого частотного диапазона, в
который входит не менее 95% мощности данной частоты, к общей мощности. Она
выражает степень замедления и ускорения активности ЭЭГ. Отмечено, что
применение фторотана изменяет SEF-95 в зависимости 8 Гц/МАК, энфлюран 20
Гц/МАК. Тиопентал снижает SEF-95 с 25 Гц при бодрствовании до 13 Гц в хирургической
стадии наркоза.
SEF-50 называют
среднемедиальной частотой, на которую приходится не менее 50% общей мощности
сигнала. SEF-50 считается некоторыми исследователями наиболее точным методом,
отражающим глубину анестезии, и менее инертным, чем SEF-95.
Электроэнцефалография была
предложена как возможная мера оценки глубины анестезии при использовании эфира,
фторотана, этомидата, метокситона, тиопентала, изофлюрана, пропофола.
Большинство исследований строилось на определении взаимосвязи между изменением
ЭЭГ и концентрации препарата в крови, включая и наблюдение за реакцией на
сенсорную стимуляцию. Отмечено, что ЦНС на фоне недостаточной анестезии в ответ
на поступление ноцицептивной импульсации из зоны оперативного вмешательства
отвечает «реакцией активации», выражающейся в десинхронизации ЭЭГ и переходе к
более быстрой электрической активности.
Однако в связи с появлением
ряда оригинальных, в первую очередь неингаляционных, средств анестезии
(дроперидол и фентанил, препараты для атаралгезии, калипсол), расширением
применения комбинированной анестезии было отмечено, что столь огромное
значение, придаваемое ЭЭГ при мониторинге глубины и адекватности анестезии,
может оказаться иллюзорным.
Вызываемые этими препаратами
изменения невозможно было уложить в рамки привычных клинических и
электроэнцефалографических классификаций наркоза. Спонтанная ЭЭГ в условиях
комбинированного анестезиологического пособия оказалась близка к ЭЭГ
бодрствования, несмотря на наличие общей анестезии и арефлексии. Или, наоборот,
отмечалось значительное запаздывание в развитии клиники наркотического
состояния от ЭЭГ-картины (например, при применении натрия оксибутирата).
Последние исследования
показали, что пока не найден «золотой стандарт», который позволил бы соотнести
изменения ЭЭГ с глубиной комбинированной анестезии. Это объясняется полифармацией
анестезирующих веществ и связанными с этим разнонаправленными изменениями ЭЭГ.
Более того, даже в условиях мононаркоза изофлюраном, по данным Rampil I.J. и Las-ter M.J.
(1992), не отмечаются дозазависимые изменения ЭЭГ при использовании различных
концентраций изофлюрана при наркозах. Drummond J.C. et al. (1991), анализируя данные
ряда энцефалографических показателей во время анестезии с использованием
изофлюрана и закиси азота, пришли к выводу, что ни один из них не может служить
достоверным признаком, предсказывающим возбуждение ЦНС в ответ на
хирургическую стимуляцию. По мнению Stanski D.R.,
причина в том, что параметры ЭЭГ, применяемые для количественной оценки
эффектов фармакологических препаратов и глубины анестезии, бьыи выбраны
эмпирически. Поэтому нет теоретически обоснованной причины тому, чтобы
предпочесть одну характеристику другой. В настоящее время нет ясного или
статистически мотивированного выбора того или иного критерия как идеального.
До последнего времени
процессы возбуждения у пациентов под наркозом принято определять по
десинхронизации ЭЭГ и появлению быстрых волн. Однако изменения на ЭЭГ при болевой
стимуляции, как выяснилось, могут выражаться не только десинхронизацией, но и
смещением в сторону медленных волн (1—3 Гц). Подобный феномен, названный
«парадоксальным возбуждением», может представлять характеристики ЭЭГ в
условиях возросшей ноцицептивной стимуляции, сходные с теми, что наблюдаются
при углублении анестезии.
Таким образом, в настоящее
время считается, что для расшифровки ЭЭГ наиболее удобна ситуация с
использованием одного анестетика, однако это бывает весьма редко, и поэтому
применение сложной и дорогостоящей ЭЭГ-аппаратуры в плане интерпретации шубины
наркоза в подавляющем большинстве случаев нецелесообразно. Поэтому в настоящее
время интраоперационньш мониторинг ЭЭГ в основном применяется для диагностики
ишемии головного мозга, во время операций на экстра- и интракраниальных отделах
бассейна сонных и верте-бральных артерий, для облегчения диагностики диффузных
церебральных расстройств при многих заболеваниях, включая метаболические
расстройства, лекарственные интоксикации, дегенеративные заболевания и гипоксию
мозга, мониторинг рефлекторной инграоперационной гипотензии и гипоксемии как
результата хирургических манипуляций. ЭЭГ «шаблоны» применяются для титрования
дозы барбитуратов и контроля эффективности гипотермии для церебральной
протекции при недостаточности кровообращения (circulatiry arrest).
Также мониторинг ЭЭГ может
быть использован для определения глубины анестезии во время вводного наркоза с
использованием барбитуратов. При помощи анализа распределения спектральной
мощности до ларингоскопии и интубации можно предсказать изменение
артериального давления на эти манипуляции. Как хорошо известно, по АДсис до
ларингоскопии нельзя прогнозировать гемодинамические изменения на эту
процедуру.
Полагают, что причина неудач
в использовании электроэнцефалографического мониторинга глубины и адекватности
проводимой анестезии происходит по следующим причинам:
1. По традиции, ЭЭГ-сигнал
рассматривается как реализация случайного процесса и для его анализа
применяются методы, основанные на преобразовании Fourier. Однако область применения
этих методов в изучении ЭЭГ ограничена, так как интерпретация различных
спектров мощности не наглядна и, более того, туманна и затруднительна. Спектральные методы
оптимальны для регулярных (синусоидальных, симметричных) периодических
сигналов, но применимость этих методов становится весьма ограниченной, когда
сигналу присуща внутренняя нерегулярность без острых пиков и хорошо
разграниченных частотных полос.
2. Электроэнцефалограмма не
является мерой концентрации анестетика в веществе мозга, скорее она является
мерой эффективности исполнения мозговых функций. Бесспорно, она — результат
работы ЦНС. Но общепринятое мнение, что замедление ЭЭГ представляет собой
подавление функциональной активности мозга — всего лишь эмпирическая
корреляция, а не отображение механизма протекающего процесса.
Вызванные
потенциалы
Вызванные потенциалы (ВП) —
это ответы ЦНС на специфические внешние стимулы. На сегодняшний день
существует более двадцати хорошо изученных компонентов ВП. Однако с целью
контроля глубины проводимой анестезии в клинике нашли применение в основном
сенсорные ВП, а именно: сомато-сенсорные (ССВП) и слуховые (аудио) вызванные
потенциалы (АВП).
Одно из несомненных
преимуществ этой методики перед всеми остальными — это возможность изучать
реакцию в ответ на четко дозированный и повторяемый стимул, что обсуждалось
нами выше.
Считается, что амплитуда ВП,
как соматосенсорных, так и слуховых, зависит от уровня антиноцептивной защиты.
В то же время латенгность ВП отражает уровень общего угнетения ЦНС.
Однако вполне вероятно, что
ССВП, благодаря специфическим проводящим путям, отражают аналгетическое, а не
гипнотическое влияние анестезии. Это можно обосновать теми наблюдениями, в
которых при применении эквипотенциальных доз различных анестетиков закись азота
подавляет ВП больше, чем другие ингаляционные анестетики, и по сравнению с
наркотическими аналгетиками такие гипнотики, как этомидат и пропофол, без
использования аналгезии не угнетают ВП. Тем не менее необходимо более
детальное исследование возможности применения данной методики мониторинга
болевой передачи у пациента под наркозом.
Что касается АВП, то было
отмечено, что с углублением анестезии происходит снижение амплитуды и
увеличение латентности ответов. Однако подобный метод может быть достоверным
только при использовании анестетиков, для которых не существует специфических
рецепторов (изофлюран).
Кортикальный компонент,
мультисинаптический по своей природе, чувствителен и угнетается большинством
анестетиков в зависимости от их дозировки. Этот компонент устойчив к
препаратам, к которым имеются специфические рецепторы, такие, как
бензодиазепины, опиоиды и кетамин. Возлагаются надежды на его использование в
качестве детектора сохранения сознания во время анестезии.
Однако, на наш взгляд, в
самом методе применения ВП для анестезиологии имеется один принципиальный
недостаток: вся информация, полученная в результате многоминутной записи ЭЭГ,
сводится к изучению сигнала, длительность которого составляет лишь долю
секунды. Иными словами, используется всего один процент той информации, которая
зарегистрирована и может быть проанализирована. К тому же сама техника регистрации
ВП позволяет производить только дискретный контроль за пациентом.
Поэтому мы считаем, что в
стратегическом плане более информативными, а, следовательно, и более
перспективными являются методы, исследующие ЭЭГ целиком.
Информационный
метод обработки ЭЭГ
В последнее время появляется
все больше данных о том, что степень детерминированности (предсказуемости) ЭЭГ
может отражать функциональное состояние ЦНС. Из теории информации известно,
что увеличение предсказуемости системы означает уменьшение ее информативности.
Поэтому было бы резонно оценивать деятельность мозга по количеству информации,
содержащейся в его биотоках.
В Институте хирургии им.
А.В. Вишневского РАМН был разработан новый метод определения количества
информации, содержащейся в ЭЭГ, используя максимальное сжатие по амплитуде при
линейном прогнозировании сигнала.
Во время предварительных
исследований на добровольцах было показано, что внешний информационный поток,
независимо от его модальности (зрительный либо аудиогенный), но в зависимости
от его интенсивности, поддерживает строго определенную активность ЦНС, что
можно количественно определить, измеряя количество информации в ЭЭГ
(информационная насыщенность ЭЭГ — ИНЭЭГ).
В ходе клинического изучения
оказалось, что динамика изменения ИНЭЭГ при хирургическом вмешательстве хорошо
коррелирует с глубиной анестезии независимо от метода общей анестезии. Так, во
время вводного наркоза уровень ИНЭЭГ снижался, а в ходе пробуждения больного
после операции восстанавливался практически до исходного. Усиление
хирургической стимуляции на фоне недостаточной анестезии приводил к резкому
подъему информационного параметра на 10—15% (рис. 19.1). Характерно, что эти
изменения опережали изменения со стороны гемодинамических показателей. На
чувствительность метода не оказывали влияния длительность операции, величина
и темп кровопотери, тогда как классические клинические признаки в основном теряют
свою информативность.

Рис. 19.1.
Фрагмент автоматизированной наркозной карты. Этап — начало операции:
1 — введение 0,1 мг
фентанила;
2 — разрез кожи. Отмечается
рост ИНЭЭГ, опережающий реакцию со стороны гемодинамических показателей;
3 — повторное введение 0,1 мг
фентанила. Все показатели возвращаются к исходному уровню.
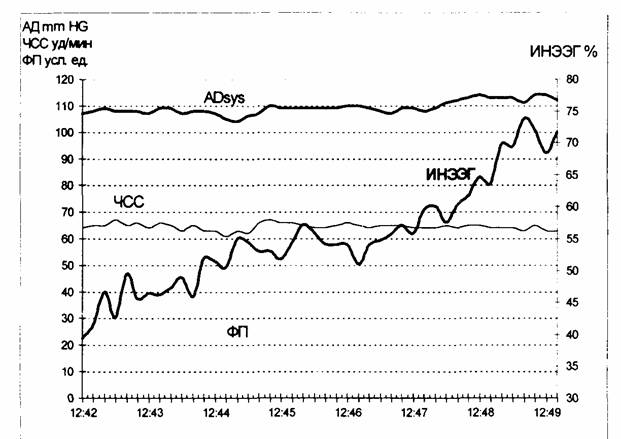
Рис. 19.2. Фрагмент автоматизированной наркозной карты
Таким образом, в ходе
исследований нами была подтверждена концепция, что ослабление
антиноцицептивной защиты, приводящее к активизации ЦНС, вызывает увеличение
количества информации в ЭЭГ, что может быть не только объективно
зафиксировано, но и количественно определено по информационным характеристикам
ЭЭГ.
Были отмечены и эпизоды роста
ИНЭЭГ при стабильном ходе операции. Введение анестетиков в этой ситуации
приводило к снижению информационного показателя (рис. 19.2). Мы не располагаем
еще статистически достоверными результатами, чтобы однозначно сказать о
возможности мониторинга интраоперационного пробуждения при помощи предложенной
нами методики, но работа в этом направлении представляется весьма
перспективной.
На рисунке представлен рост
ИНЭЭГ с 40 до 75%, что в условиях стабильного хода операции можно расценить как
интраоперационное пробуждение. Реакция со стороны гемодинамических параметров
проявляется только снижением амплитуды ФП.
Заключение
Появление новых методов
мониторинга, модификация и повышение точности уже традиционных, апробированных
методов в целом не привели, точнее, не приблизили нас сообразно затраченным
средствам к выработке однозначной оценки адекватности анестезии. То есть мы до
сих пор порой не в состоянии ответить на вопросы: испытывает ли пациент боль?
Достаточна ли анестезия, чтобы предотвратить интраоперационное пробуждение
больного? Способность анестезиологов эффективно предупреждать развитие
подобных ситуаций будет улучшаться по мере дальнейшего развития исследований.
В этой ситуации становится
понятна та важность соблюдения протоколов, если хотите, традиций или даже
ритуала проведения анестезии, безукоризненного знания аппаратуры, механизма
действия лекарств и их дозы. Жизнь человека слишком ценна, чтобы пренебрегать
опытом ошибок и трагедий.
Рекомендуемая литература:
Битнер Р.Л. Сознание во время операции.
— В кн: Осложнения при анестезии/Под ред. Ф.К. Оркина., Л.Х. Куперман.—М.,
1985.— Т. 1.—С.ЗЗ 1—339.
Бунятян А.А., Флеров Е.В.,
Толмачев В.А. и др. Компьютерный мониторинг биоэлектрической активности
головного мозга в операционной // Анестезиология и
реаниматология.—1985.—№.5.—С.6.—9.
Викерс М.Д. Проблема сознания во
время анестезии // Анестезиология и реаниматология.—1990.—№.5.—С.3—7.
Ефуни С.Н. Электроэнцефалография в
клинической анестезиологии. —М., 1960.
Жоров И.С. Общее обезболивание в
хирургии.—М.: Медгиз, 1959.
Зильбер А.П. Клиническая физиология в
анестезиологии и реаниматологии.—М., 1984.
Клецкин С.3. Математический анализ ритма
сердца (научный обзор).—М., 1979.
Лихванцев В.В., Смирнова
В.И., Ситников А.В. и др. Электрофизиология центральной нервной системы при эффективной
анесте-зии//Вестн. РАМН.—1995.—№ 6.—С.22—27.
Осипова Н.А. Оценка эффекта
наркотических, аналгетических и психотропных средств в клинической
анестезиологии. — Л.: Медицина, 1988.
Петров О.В. Информационные методы оценки
состояния и защиты ЦНС при хирургических операциях //Автореф. дисс. ... док.
биол. наук.—М., 1997.
Субботин В.В. Влияния мониторинга
вызванных потенциалов на безопасность выполнения оперативных вмешательств
различной степени сложности в абдоминальной хирургии//Автореф. дисс. ... канд.
мед. наук.—М.,1994.
Frost EAM. Electroencephalography and
evoked potential monitoring.—In: Monitoring in Anesthesia—3rd ed. (ed. LJ
Saidman, NT Smith).—Boston, Butterworth-Heinemann, 1993.—P. 203—223.
Jones JG. Awareness under anaesthesia//Anaesthesia
Rounds, 1988,21.
Pichelmayer I, Lips 1), Kunkel H, eds.
The electroencephalogram in anesthesia.—Berlin: Springer-Verlag, 1984.
Stanski DR. Monitoring depth of
anesthesia.—In: Miller RD (ed) Anesthesia, Churchill, Livingstone.—NY., 1990.
Stanski DR. Monitoring for awareness
during anesthesia.— In:Saidman LJ, Smith NT, ed. Monitoring in anesthesia,
ed3.— Boston: Butterworth-Heinemann, 1993.—P. 225—231.
Глава 20
КРАТКИЕ
СВЕДЕНИЯ О МЕХАНИЗМЕ БОЛИ И ОБЕЗБОЛИВАНИЯ
О.
В. Петров
Боль является одним из
фундаментальных понятий в медицине. Несмотря на то, что каждый человек знает,
что такое боль, ни одно из определений боли не может считаться исчерпывающим.
Боль многообразна, ее оттенки описаны 102 терминами медицинской литературы (R. Melzack, W. Torgerson,
1971).
Столь же многообразны и
методы борьбы с болью, что скорее является недостатком, так как указывает на
то, что универсального средства борьбы с болью нет, равно как и нет единой
теории боли.
История развития теории боли
насчитьшает более ста лет. Первую научно обоснованную концепцию боли предложил Frey
(1895). Его теория специфичности подразумевала существование специфических
афферентных болевых путей, передающих в головной мозг возбуждение от болевых
рецепторов.
Альтернативой данной
концепции явилась теория интенсивности, впервые сформулированная Гольшейдером
(1894), поддержанная затем многими авторами. В нашей стране А.В. Вальдман
(1980) и В.М. Хаютин (1980) развили эту теорию, установив, что главное
значение для формирования боли имеет интенсивность раздражителя. При повышении
уровня интенсивности суммарного неспецифического потока до критического в
головной мозг поступают особые сигналы, запускающие центральный аппарат
ноцицепции.
Концепция, объединяющая
теорию специфичности и теорию интенсивности, была предложена С.В. Ревенко с
соавт. (1992). В соответствии с ней, в организме имеются специализированные
ноцицептивные нейроны с С-аксонами. Их кожные окончания возбуждаются на низких
частотах (менее 2 Гц) разнообразными неболевьми стимулами, а предъявление
ноцицептивных стимулов ведет к высокочастотному возбуждению (свыше 2 Гц).
На этих данных авторами была
основана новая идея местного обезболивания — подавление высокочастотных
разрядов ноцицепторов при сохранении низкочастотных разрядов (т.е. при
сохранении тактильной чувствительности).
Разновидностью теории
интенсивности явилась теория паттерна (G. Weddell, 1955; D.C. Sinclair,
1955), согласно которой все виды кожной чувствительности являются результатом
пространственных и временных паттернов импульсов, а паттерн, типичный для
боли, возникает при сильном раздражении неспецифических рецепторов.
Обширный материал,
почерпнутый из клинической практики, выявил такие феномены боли, как временная
и пространственная суммация, продолжение боли после заживления раны и т.д..
Попыткой объяснить эти явления явилась воротная теория боли (Р. Мелзак, 1981),
суть которой состоит в том, что в системе сенсорного входа в спинном мозге
существует специальный механизм контроля, регулирующий поток импульсации с
периферии в вышележащие отделы, относящиеся к ноцицептивной системе. Развитие
этой теории (А.В. Вальдман, 1976, 1980) выявило, что целостная ответная реакция
при болевом воздействии определяется двумя физиологическими системами:
— ноцицептивной
гомеостатической системой сегментарного уровня, обеспечивающей активацию
защитных реакций;
— антиноцицептивной
надсегментарной системой, осуществляющей контроль афферентного входа.
Специфические действия
центральных аналгетиков проявляются в сфере обеих систем:
— на спинальном уровне
аналгезии блокируют восходящий поток болевой информации за счет уменьшения
активации нейронов заднего рога спинного мозга через высокопороговые
«ноцицептивные входы»;
— наряду с этим они усиливают
нисходящие модулирующие влияния антиноцицептивных структур, что приводит к
уменьшению восходящего «ноцицептивного» потока до безопасного уровня,
исключающего формирование негативного эмоционального ощущения и комплекса
защитных реакций.
В наиболее общем виде
развитие теории боли представляет эволюцию ответа на вопрос, который
сформулировал Р. Мелзак (1981 г.): «Исследует ли мозг только специфическую
информацию, поступающую по специфическим волокнам, или контролирует весь вход
и принимает решение, исходя из абсолютного числа нервных импульсов во всех
активных волокнах?»
Независимо от вопросов,
касающихся теории боли, проводились многочисленные фармакологические
исследования по поводу формирования антиноцицептивных реакций организма и
механизма действия наркотических аналгетиков. По данным фармакологического
анализа, большая роль в этом принадлежит центральным дофамин-, холин- и
серотонинергическим системам, а также эндогенным морфиноподобным субстанциям
(Вальдман А.В., 1980; Денисенко П.П., 1983; Berge O.G. et al., 1983, и др.).
Учение об аналгезии и
механизмах действия наркотических аналгетиков было затем дополнено открытием
специфических опиоидных пептидов (энкефалинов и эндорфинов), когда было
обнаружено, что при действии болевых раздражителей в организме происходит
физиологическая активация эндорфинного аппарата. В последующем было показано,
что функции эндогенной опиоидной системы, направленной на уменьшение
повреждающего действия болевого фактора, недостаточны как естественные
ингибиторы боли (Ghia J. et al.,
1981). Детальные исследования обнаружили, что опиоидные рецепторы являются
точкой приложения действия наркотических аналгетиков, уменьшающих восприятие
болевых ощущений (Машковский М.Д. с соавт., 1980). Было показано, что
количество опиоидных рецепторов в ЦНС является одним из факторов, определяющим
ноцицепгивную реактивность животных (Michand J. et al., 1981). И, наконец, был выявлен факт того, что
эндогенная опиоидная система принимает участие в реализации эффекта не только
аналгетиков, но и других общих анестетиков (Булаев В.М., 1982).
Таким образом, данные,
полученные при фармакологических исследованиях, существенно дополнили
представление о функционировании антиноцицептивной системы. Однако между
учением об аналгезии, с одной стороны, и теорией боли — с другой, по-прежнему
не существует полноценной концептуальной связи. До сих пор не ясен ответ на
вопрос о том, когда и на каком уровне ноцицептивная импульсация перестает быть
просто импульсацией и становится болью и как фармакологические и
нефармакологические средства эту боль устраняют. Понятно, что без четкого
представления об этом поиск надежных методов борьбы с болью будет оставаться
малоэффективным, а успехи — случайными.
НЕМЕДИКАМЕНТОЗНЫЕ МЕТОДЫ ОБЕЗБОЛИВАНИЯ
Основной причиной, которая
побудила развивать немедикаментозные методы обезболивания, является то, что
они лишены многих из тех нежелательных негативных побочных эффектов, которые
присущи их фармакологическим аналогам. Однако и эффект от применения этих
методов во многих случаях не является стопроцентным и поэтому, как правило,
требует дополнительной поддержки другими методами.
Ниже мы приводим краткое
описание некоторых, с нашей точки зрения наиболее интересных, методов
немедикаментозного обезболивания.
Электроанестезия
В анестезиологической
практике на протяжении последних десятилетий для обеспечения аналгетического
компонента общей анестезии с переменным успехом применяются различные методы
электроимпульсного воздействия на ЦНС, объединенные под общим названием
«электроанестезия».
Исследованиями многих
авторов установлено, что электроанестезия не оказывает токсического действия
на организм. В.Д. Жуковский (1964), обследовав больных через 6 месяцев после
электроанестезии, не обнаружил каких-либо нарушений интеллекта и патологических
признаков в психоневрологическом статусе. Аналогичные данные получены L. Fabian и
соавт. (1961), К. Shimoji и соавт.(1971), Mane (1975), Ю.С. Демин, В.Д.
Жуковский (1969) доказали, что электроанестезия, в отличие от
фармакологической, характеризуется цитогенетической нейтральностью. М.И. Кузин
(1976) считает, что общая электромедикаментозная анестезия относится к наименее
токсичным способам в анестезиологии.
Мнение авторов о параметрах
электрического тока для электроанестезии разноречивы. Одни авторы применяют
низкочастотный ток. Так, Г.С. Календаров и Е.И. Лебединский (1953)
использовали импульсный прямоугольный ток частотой 75— 175 Гц, длительностью
импульса 0,5—1 мС и силой тока 5— 7 мА. Другие предпочитают более высокую
частоту. Например, Жуковский с соавт. (1965) применял ток частотой 6—8 кГц.
По мнению большинства
исследователей, правильно выбранный режим электростимуляции и соответствующее
расположение электродов способны существенно снизить необходимые для аналгезии
дозы общих анестетиков или наркотических аналгетиков.
Было показано (В.А. Светлев
и др., 1996), что транцеребральное электровоздействие серийными аппаратами
«ЛЕНАР» и «ЭЛЕАН» способствует снижению расхода наркотических аналгетиков более
чем в 2 раза при сверхдлительных пластических операциях.
Аналгетическое действие
электроимпульсной терапии применялось у различного контингента хирургических
больных во время сложных вмешательств, вплоть до операций, выполняемых в
условиях искусственного кровообращения (М.Я. Авруцкий, М. Наби, 1982; М.Я.
Авруцкий и др., 1983; В.И. Сачков и др., 1986; С.И. Авдеев, 1987).
Единственным, но весьма
весомым недостатком любого метода электроанестезии является то, что он перестает
«работать» или проявляет гораздо меньшую эффективность, как только вырывается
из рук автора и начинает использоваться практикующими врачами. Далее будет
предпринята попытка объяснить механизм подобного явления.
Аудиогенная
анапгезия
Явление, известное как
«аудиогенная аналгезия», было открыто W.J. Gardner и J.C. Lickliner в 1959 г. Суть явления состоит
в том, что сильная аудиогенная стимуляция подавляет боль при лечении зубов.
Этот феномен вызвал огромный интерес как новый перспективный способ для подавления
боли.
На некоторых пациентов
аудиогенная процедура оказывала весьма эффективное действие. Было отмечено, что
даже экстракция зубов была совершенно безболезненной. Это явление, в тех
случаях, когда оно имело место, было поразительным, однако оно далеко не всегда
давало эффект, так как сильный звук великолепно действовал на одних пациентов и
совсем не действовал на других. Более того, в лабораторных опытах, при которых
авторы использовали воздействие тепловым излучением на кожу (W. Camp, R. Martin, L.F. Chapman,
1962) или электрическим током на зубы (S. Carlin, W.D. Ward, A. Gershon, R. Ingraham, 1962), они не наблюдали
никакого влияния аудиогенной стимуляции на порог болевой чувствительности.
Основываясь на этом, авторы сделали вывод, что результаты, наблюдаемые в
клинике, нельзя приписать действию какого-то одного простого механизма.
Необходимо учитывать другие факторы, такие, как внушение, отвлечение внимания
и уменьшение тревоги. На несколько десятилетий о теории аудиогенной анестезии
забыли.
ИНФОРМАЦИОННАЯ КОНЦЕПЦИЯ БОЛИ И
ОБЕЗБОЛИВАНИЯ
Основные положения
Любая теория нужна для того, чтобы обобщить имеющийся экспериментальный (и клинический) материал и дать прогнозы на будущее. Если прогнозы сбудутся, то это означает, что теория верна. Существующие теории боли не в состоянии объяснить механизмы обезболивания для того обширного арсенала методов, фармакологических и нефармакологических, которым в настоящее время владеет практическая медицина. Поэтому поиск новых, эффективных методов обезболивания вдет не планомерно — научным, а спонтанно-эвристическим путем.
Ясно, что, поскольку такой
путь малоэффективен, то долго с ним наука не может мириться. И поэтому в
образовавшийся вакуум хлынули смежные области. Наибольшего успеха в этой
конкурентной гонке добилась молодая, но прогрессирующая в развитии наука —
кибернетика.
Кибернетика оперирует с
основным понятием природы — информацией. Это понятие является таким же
фундаментальным, как и понятие массы и энергии. Поэтому так же, как масса и
энергия, информация может быть количественно определена. Единицей измерения
информации является бит. Свойства информации еще далеки до полного понимания.
И для нас остается загадкой, как в сверх плотных сгустках информации может
возникнуть сознание. Но определенный успех на пути к этому уже имеется.
Применение простых информационных подходов позволяет ответить на вопрос,
касающийся предмета нашего изучения: что такое боль и что такое обезболивание.
Уже давно исследователи
считают, что боль — это не просто физиологическое, а скорее всего
психофизиологическое явление. Мы добавим, что оно еще является и кибернетическим
явлением.
Результаты исследований,
проведенных в лаборатории анестезиологии Института хирургии им. А.В.
Вишневского РАМН, продемонстрировали удивительный факт. Оказалось, что визуальная,
аудиогенная и ноцицептивная информация в принципе одинаково влияют на ЭЭГ.
Создается впечатление, что модальность информационного потока является
внутренним (недоступным) параметром ЭЭГ, а количество информации в этом потоке
является внешним, легко определяемым параметром. Это наталкивает на мысль о
том, что ЦНС организована таким образом, что информационные потоки различных
модальностей для нее являются равнозначными. Не существует заведомо приоритетных
модальностей. В частности, ноцицептивная информация обрабатывается в ЦНС по
тем же законам, что и, например, зрительная информация, где, как известно
(Б.К. Хорн, 1989), основным моментом является распознавание зрительных
образов. По аналогии можно допустить, что обработка в ЦНС ноцицептивной
информации заключается в распознавании «образа боли». Многочисленные факты, а
так же анализ существующих теорий позволяют сформулировать новую концепцию
боли, дав ответ на один только вопрос, заданный вначале: когда ноцицептивная
импульсация перестает быть просто импульсацией и становится болью, — тогда,
когда произошел процесс распознавания «образа боли» в ЦНС? Это определение
обладает одним колоссальным преимуществом, — оно легко позволяет сформулировать,
что общее обезболивание — это изменение процесса распознавания «образа боли» в
ЦНС.
Справедливость предложенной
концепции можно подтвердить только одним способом — показать, что все хорошо
изученные медикаментозные и немедикаментозные способы общего обезболивания
можно в той или иной степени рассматривать как изменение распознавания «образа
боли» в ЦНС.
Распознавание образов
является чисто информационньш процессом, и теоретически можно предположить
несколько вариантов их изменений:
— разрушение
распознавания образов;
— перепрограммирование
образа боли;
— конкурентное вытеснение
информации из ЦНС. Ниже мы приводим описание этих вариантов и известные методы общего
обезболивания, которые им соответствуют.
Анализ
методов общего обезболивания
Определение боли, которое мы
сформулировали, является настолько общим, что оно в принципе не может быть
неверным. Легко показать, что это определение не противоречит ни одной из существующих
теорий боли. Польза этого определения заключается в том, что оно позволяет
понять на информационном уровне, что есть обезболивание, и объясняет его различные
механизмы.
Фармакологическое
обезболивание
Разрушение распознавания образов
Самый простой способ
обезболивания, который можно себе представить в рамках информационной концепции
боли, связан с нарушением распознавания ноцицептивной информации. Однако здесь
возникает удивительный парадокс: этим способом принципиально невозможно
заблокировать распознавание только лишь «образа боли», не затронув
распознавание других образов. Это следует из того, что прежде чем избирательно
изолировать поступившую информацию, ее надо предварительно распознать. В нашем
случае это означает, что для того, чтобы заблокировать только боль, ее образ
предварительно необходимо четко отдифференцировать от других образов. То есть
чтобы боль не чувствовать, ее надо почувствовать.
Это противоречие означает,
что разрушение распознавания «образа боли» возможно лишь путем нарушения
распознавания образов вообще, т.е. при этом обязательно должно наблюдаться
нарушение восприятия и других образов. Такое утверждение является достаточно
сильным. Оно получено чисто логическим путем из информационной концепции боли.
Поэтому любые экспериментальные или клинические примеры, подтверждающие (или
опровергающие) его, автоматически подтверждают (или опровергают) и саму
информационную концепцию боли.
Перейдем к примерам. Наиболее
распространенный метод обезболивания основан на эффекте применения общих
анестетиков и аналгетиков центрального действия. Однако практика показывает,
что эти препараты оказьшают аналгетическое действие только в тех дозах, когда
происходит и реализация различных побочных эффектов, которые можно
интерпретировать как нарушение распознавания образов.
Например, фентанил является
мощным аналгетиком. Но в тех дозах, в которых он вызывает обезболивание,
происходит и угнетение дыхания. А это можно интерпретировать как нарушение
распознавания концентрации газов в крови. Морфин, оказывая аналгетическое
действие, нарушает ассоциативное восприятие. Кетамин, защищая от боли, вызывает
галлюцинации и т.д. Все без исключения ингаляционные анестетики (эфир,
галотан, изофлюран и пр.), обеспечивая аналгезию, приводят и к неадекватному
восприятию (И.С. Жоров, 1964). Все это есть ни что иное, как различные формы
нарушения распознавания образов.
Существуют и «экзотические»
методы обезболивания. Например, известно, что большое атмосферное давление
(6—10 атм) увеличивает пороги болевого восприятия. Однако и это происходит в
результате общего наркотического влияния азота на организм при повышенных
давлениях.
Можно до бесконечности
множить этот ряд примеров. Однако лучше сказать, что в анестезиологической
литературе не известен факт, который бы противоречил наблюдаемой закономерности.
Поэтому можно взять на себя смелость утверждать, что в настоящее время не
существует и, если предлагаемая теория справедлива, в принципе не может
существовать аналгетик центрального действия, который бы не вызывал сопутствующих
явлений, в той или иной степени связанных с общим нарушением распознавания образов.
Интерес представляют
объективные данные, связывающие аналгетические свойства фармакологических
препаратов центрального действия с потерей когнитивных функций ЦНС. В этой
связи следует отметить, что ранее (А.А. Папин, О.В. Петров, М.А. Вагина с
соавт., 1982) мы обнаруживали изменение амплитуды поздних компонент ВП при
изучении седативно-транквилизирующего эффектаразличных лекарственных
препаратов. Нами было показано, что применение мощного отечественного
транквилизатора — феназепама достоверно уменьшает амплитуду ВП различных
модальностей. При этом, как показали исследования, проведенные методом тепловой
алгезиметрии (А.А. Папин, О.В. Петров, Ф.Ф. Какурин с соавт., 1983), происходит
достоверное увеличение порога болевой чувствительности, превосходящее по
величине действие морфина более чем на 40%.
На рис.20.1
продемонстрирована индивидуальная запись ВП одного из испытуемых, принимавшего
феназепам в дозе 0,05 мг/кг. Видно, что через 2 ч после приема препарата
перорально ВП практически не регистрировался. При этом увеличение порога
болевой чувствительности составило более 80%.
Рис. 20.1. Изменение ВП после перорального приема феназепама в дозе
0,05мг/кг, через 2 и 4 ч
Таким образом, известные
электрофизиологические данные, а также клинические и экспериментальные
наблюдения показывают, что механизм фармакологического обезболивания скорее
всего основан на методе нарушения общего распознавания образов в ЦНС.
Нефармакологические
методы обезболивания
Нарушение общего
распознавания образов в ЦНС является основным способом общего обезболивания. На
нем основаны все методы фармакологической аналгезии центрального действия.
Однако, как известно, в медицине достаточно широко распространены и
нефармакологические способы общего обезболивания. Интерес представляет
выявление механизма, на котором основано действие и этих методов. Естественно,
если удастся его определить, находясь в рамках информационной концепции боли,
то это будет лучшим подтверждением этой концепции.
Перепрограммирование «образа боли»
Информационная концепция боли
допускает ситуацию, при которой ноцицептивная информация доходит до ЦНС, но
распознается не как боль, а как нечто иное. То, как именно она будет
распознаваться, целиком и полностью зависит от нового «шаблона», который будет
введен на место старого, служившего стандартом «образа боли». Оказывается, эта
почти фантастическая ситуация была давно известна и часто использовалась в
различных вариантах.
На наш взгляд, наиболее ярким
и убедительным примером такой возможности явились исследования в лаборатории
И.П. Павлова (И.П. Павлов, 1951).
В норме собаки очень резко
реагируют на сильный удар электрическим током по лапе. Однако если после
каждого удара давать собаке еду, у нее на основе условного рефлекса
вырабатывается положительная реакция: собака радостно виляет хвостом, с
нетерпением поворачивается к миске, у нее начинается слюноотделение. Раньше
этот факт приводили как пример извращения физиологической реакции. Однако
имеющиеся у нас данные позволяют интерпретировать результаты этих опытов как
перепрограммирование «образа боли», вызванной электрокожным раздражением, в
образ, сопутствующий приему пищи. Причем примененный условно-рефлекторный метод
оказался очень эффектным для подопытных животных.
Понятно, что для человека он
мало пригоден, поэтому для нас актуальным оказался поиск таких аналогов этого
метода, которые могли бы быть приемлемыми в медицинской практике.
Наш поиск не был
продолжительным. Один из сотрудников нашей лаборатории, канд. мед. наук В.Л.
Виноградов, владеющий гипнозом, по нашей просьбе, в порядке исследования,
внушил обезболивание одному из добровольцев. И действительно, антиноцицепция
имела место. На это указывало полное исчезновение реакций гемодинамики (ЧСС,
плетизмограмма) на ноцицептивное раздражение, которое мы вызывали ударами
электрического тока на проекцию срединного нерва предплечья. Но каково было
наше удивление, когда мы обнаружили, что болевые ВП в ответ на эти стимулы не
исчезли! Возник парадокс: ВП в коре головного мозга в ответ на болевое раздражение были, но ощущения
боли при этом не было. Единственное разумное объяснение этому феномену было
следующим. Во время внушения произошло перепрограммирование «образа боли», по
типу того, как это было в опытах И.П. Павлова.
Мы нашли в научной литературе
исследования (Шагас, 1975), в которых также указывалось на то, что болевые ВП
при внушении обезболивания под гипнозом не изменяются. Эти данные подтверждают
наш вывод о том, что перепрограммирование «образа боли» действительно является
фактом, который имеет место при внушении обезболивания. Практическим
результатом из этого вывода может служить рекомендация по технике гипноза:
При внушении обезболивания
надо помогать больному «перепрограммировать» шаблон боли. Для этого следует не
просто давать команду: «А теперь вы не чувствуете никакой боли», — а внушать,
что «то, что вы сейчас будете чувствовать, доставит вам приятные ощущения», и
это должно значительно улучшить эффект обезболивания.
Таким образом, обезболивание
методом перепрограммирования «образа боли», существует в действительности и
может быть продемонстрировано как в экспериментальных условиях, так и в
клинической практике.
Конкурентное вытеснение
ноцицептивной информации из ЦНС
Принципиальная возможность
конкурентного вытеснения ноцицегггивной информации из ЦНС стала очевидной из
наших экспериментальных исследований. В этих исследованиях мы обнаружили, что
между количеством информации во входном информационном потоке, будь он
визуальный либо аудиогенный, и количеством информации в ЭЭГ существует прямая
линейная связь только до определенных значений интенсивности «на входе». При
величине входного потока более 2,5 бит/сек. происходит информационное насыщение
и прекращается дальнейший рост информации в ЭЭГ. При этом кривая ЭЭГ становится
похожей на «белый шум», а испытуемый начинает допускать ошибки при выполнении
команд на поступающие сигналы. Это может быть связано либо с тем, что мозг
человека уже не может переработать большее количество информации, либо с тем,
что существуют задержки в сенсорной системе, и из-за большого латентного
периода сигналы не могут поступать с большей частотой.
Мы провели исследование (10
человек), при котором входные сигналы были попеременно то звуковой, то
световой модальности. Однако и в этом случае насыщение происходило при
суммарной величине входного потока, равной 2,5 бит/сек. Следовательно,
поскольку по каждому каналу, и звуковому, и световому, информационный поток не
превышал 1,25 бит/сек., остается справедливым первое предположение:
лимитирующим является ограничение в целом по объему информации, способной быть
воспринятой ЦНС. Результаты проведенного исследования показывают, что звуковые
и световые потоки информации находятся в конкурентном соотношении при
обработке их в ЦНС. Безошибочное восприятие акустического потока информации
уменьшает правильную обработку зрительного потока информации, и наоборот.
Можно предположить, что и
ноцицептивная информация находится в таком же конкурентном соотношении со всеми
другими видами существующих информационных потоков. В этом случае, при
соблюдении определенных условий, можно ожидать конкурентное вытеснение
информации о боли или ноцицептивных воздействиях потоками информации другой модальности.
И действительно, мы нашли в литературе описание исследований, посвященных
эффекту аудиогенной анестезии, результаты которых можно интерпретировать как
информационное вытеснение боли.
R. Melzack,
A.Z. Weisz, L.T. Sprague (1963) провели изучение
эффекта аудиогенной аналгезии. С помощью холодового теста (погружение руки в ледяную
воду) они вызывали глубокую боль. При этом звуковая стимуляция осуществлялась
с помощью модифицированного генератора белого шума или набора магнитофонных
лент со стереофонической музыкой, стереофонических наушников и коробки
управления, которую обследуемый держал в свободной руке. У коробки управления
было две ручки для управления громкостью звука: одна для музыки, другая для
шума. Тот же прибор генерировал и «плацебо-стимул». При этом переключатель
препятствовал тому, чтобы музыка или шум доходили до испытуемого, вместо этого
он слышал 60-герцовый гул малой интенсивности, который становился чуть громче
при повороте ручки управления громкостью.
Три группы испытуемых прошли
по два контрольных обследования (без звуковой стимуляции и внушения), чтобы определить,
как долго они могут выносить боль, и два экспериментальных обследования,
чередуя их со следующими условиями:
— обследуемые I группы
подвергались сильной акустической стимуляции, но не получили четкого внушения
о цели музыки и шума. Каждый обследуемый находился под действием музыки и шума
максимальной громкости. Он должен был поворачивать ручку управления громкостью
и шума, чтобы поддерживать постоянное соотношение между громкостью музыки и
шума. Когда боль становилась невыносимой, он должен был сказать «стоп»;
— обследуемые II группы
получали те же указания, но при этом им внушили, что стоматологи в стране
установили, что сильное слуховое раздражение чрезвычайно эффективно облегчает
боль. Обследуемому сообщали, что «сильный шум препятствует тому, чтобы боль
достигла сознания»;
— обследуемым III группы
предъявляли «плацебо-стимул» и делали сильное внушение. Им сообщали, что
стоматологи установили, что ультразвук чрезвычайно эффективен в облегчении
боли, Поскольку он препятствует тому, чтобы боль доходила до сознания. Каждому
из испытуемых сообщали, что он будет слышать низкочастотный гул (60 Гц),
громкость которого будет указывать на величину действующего ультразвука. Ему
советовали увеличивать громкость ультразвука по мере усиления боли, «Поскольку
ультразвук большей силы дает большее облегчение, чем ультразвук небольшой
силы».
Эксперимент дал четкие
результаты. Сильное звуковое раздражение в сочетании с сильным внушением о
том, что оно снимает боль (II группа), дало заметное увеличение длительности
толерантности к боли по сравнению с контрольными обследованиями без
раздражения. В отличие от этого, сильное аудиогенное раздражение без четкого
внушения (I группа) или четкое внушение без акустического сопровождения (III
группа) не увеличивали длительность толерантности к боли по сравнению с
результатами, полученными в контрольной группе.
Особый интерес для понимания
результатов проведенных наблюдений представляет то, как обследуемые применяли
музыку и шум для «подавления» боли. Было ясно, что они не просто пассивно
подвергались аудиогенной стимуляции слухового нерва, а концентрировали свое внимание на
музыке, улавливая ее с помощью ручки управления громкостью звука, выбивая в
такт ей дробь ногами, подпевая ей, т.е. активно отводили свое внимание от
неотвратимой, медленно усиливающейся боли.
На основании проведенных
исследований авторы сделали вывод о том, что термин «аудиогенная аналгезия»
является неправильным. Звуковое раздражение не вызывало аналгезии, а лишь
служило средством для модуляции толерантности к боли.
Они также заключили, что
«аудиогенная аналгезия» может оказаться эффективной в руках врачей,
представляющих собой сильную личность, которые умеют убедительно внушить своим
пациентам, что они не почувствуют никакой боли. Но оно будет неэффективно в
руках тех, кто использует эти приборы с робостью, или тех, кто просто надевает
пациентам наушники и приступает к делу. Кроме того, врачи отмечают, что сама
личность пациента также является важной переменной величиной. Поскольку разные
люди имеют различную степень внушаемости, то в этой ситуации немаловажную роль
играет взаимодействие между степенью внушаемости пациента и влиянием личности
врача.
Следует заметить, что вскоре
это открытие было забыто, так как к каждому прибору для «аудиогенной аналгезии»
требовался врач, представляющий собой сильную личность.
В свете нашей информационной
теории ясно, что для того, чтобы боль была вытеснена из ЦНС конкурентным
способом, необходимы два условия:
— во-первых, чтобы
присутствовал внешний поток информации максимальной величины;
— во-вторых, чтобы этот
поток информации воспринимался ЦНС полностью.
Действительно, в I группе
испытуемых был внешний поток информации (музыка и шум), однако эта информация
не усваивалась так как члены группы не получили четкого внушения о цели музыки
и шума.
В III группе информация могла бы
усваиваться (члены группы получили четкое внушение о цели ультразвука), однако
самой информации не было, так как известно, что синусоида, а именно таковой
являлся низкочастотный гул, который должны были воспринимать испытуемые III
группы, несет минимальное количество информации.
И наконец, во II
группе присутствовали оба условия: была информация (шум и музыка), и эта
информация полностью воспринималась, что подтверждалось тем, что, во-первых,
члены группы получили четкое императивное внушение о цели музыки и шума, а
во-вторых, тем, что они концентрировали свое внимание на музыке, регулируя звук
с помощью ручки управления громкостью, чыбивая в такт ей дробь ногами, подпевая
и т.д. Понятно, что именно по этим причинам информационное вытеснение боли
происходило только у членов II группы.
Кроме того, также становится
понятным, почему для успешной работы прибора «аудиогенной аналгезии» необходим
врач, представляющий собой сильную личность. Он необходим для того, чтобы
внушить и заставить пациента воспринимать звуковые сигналы как значимый поток
информации, т.е. заставить пациента обращать активное внимание на звук.
Как было показано выше,
колоссальные усилия были направлены на получение немедикаментозного компонента
обезболивания с помощью электроимпульсного воздействия при общей анестезии
(Кузин М.И. с соавт., 1976, Сигаев В.В., 1972, Шлозников Б.М., 1979, Абрамов
Ю.Б., 1971, Цибуляк В.Н., 1985, Бабкина Н.В., 1990, Острейков И.Ф. с соавт.,
1995). Как правило, в этих работах электрический ток пропускали через
электроды, расположенные на коже головы. При этом исследователи предполагали,
что ток, взаимодействуя с определенными, но пока неизвестными структурами в
ЦНС, будет вызывать аналгезию. И действительно, целый ряд сообщений подтверждал
этот факт. Однако в подтексте этих исследований отмечается также противоречивый
характер получаемых данных. Существуют указания на отсутствие стабильных
результатов. Обнаружено, что форма применяемых токов имеет важное значение.
Сообщали, что токи, имеющие вид чистой синусоиды, абсолютно неэффективны,
поэтому, дабы избежать явления привыкания, необходимы токи, имеющие сложную
форму, переменную частоту и т.д. К сожалению, из-за отсутствия понимания
механизмов обезболивания интерес к электроанестезии стал угасать раньше, чем
бьсто проведено какое-либо глубокое изучение этого явления, такое, как в
примере с «аудиогенной аналгезией» (R. Melzack, A.Z. Weisz, L.T. Sprague, 1963). Однако целый ряд
косвенных данных показывает, что в тех случаях, когда применяли
электроанестезию, результат был вызван по крайней мере не прямым действием
электрического тока.
На это, например, указывают
исследования (Петров О.В., Вагина М.А., 1988) с применением метода фильтрации
ЭЭГ при действии на ЦНС электрических токов (Петров О.В., Вагина М.А., 1985), в
которых показано, что электрическая стимуляция головного мозга током вплоть до
50 мА аппаратами для электроанестезии различных модификаций не меняет характера
ЭЭГ. Скорее всего положительный результат от электроимпульсного воздействия
наблюдали тогда, когда неконтролируемым образом выполнялись оба выше
сформулированных требования.
Таким образам, анализ
исследования аудиогенной аналгезии, равно как и опыт электростимуляционного
обезболивания, указывают на то, что в основе механизмов действия рассмотренных
немедикаментозных методов обезболивания может быть заложен метод
информационно-конкурентного вытеснения боли.
Основное отличие этих методов
друг от друга заключено в модальности носителя информации: в первом случае
модальность сигнала звуковая, во втором — соматосенсорная. Это отличие
является принципиальным для технической реализации метода, но оно совершенно не
важно с точки зрения механизма обезболивания. Поэтому в принципе можно ожидать
эффективное обезболивание, основанное на конкурентном вытеснении информации из
ЦНС, при использовании любой другой модальности входного сигнала.
Для того чтобы с уверенностью
продемонстрировать справедливость наших представлений, нами была проведена
проверка этого предположения на примере информационного потока зрительной
модальности.
Мы изучали реакцию ЦНС в
ответ на болевое раздражение электрическим током. Для этого регистрировали
болевые ВП. Предварительно нами была разработана и апробирована модель
информационно-конкурентного обезболивания, для успеха которой в ее основу было
заложено одновременно выполнение двух условий, сформулированных выше:
— во-первых, присутствовал
внешний поток информации максимально воспринимаемой величины;
— во-вторых, этому потоку был
придан наивысший приоритет.
Для этого испытуемого
помещали в изолированную комнату перед экраном компьютера, на котором
запускали захватывающую, с точки зрения самого испытуемого, информационную игру. Для приобретения
необходимых навыков предварительно проводился процесс обучения.
Были исследованы десять
добровольцев, соматически и психически здоровых людей.
У каждого испытуемого ВП
регистрировали подряд три раза при одной и той же силе раздражающего тока, равной
индивидуальной величине порога болевой чувствительности. Первый раз — в
спокойном состоянии, второй — при максимальной для данного испытуемого
информационной загруженности по нашей модели, третий — снова в спокойном
состоянии.
Анализ результатов исследования
показал, что при максимальной информационной загруженности (вторая запись)
происходит резкое уменьшение амплитуды ВП в среднем до 50±10% (за 100% принята
амплитуда ВП при первой регистрации). Это уменьшение является достоверным (р
< 0,05) по отношению как к первой, так и к последней (третьей) записи.
Третья регистрация выявила, что амплитуда ВП восстанавливалась в среднем до
90±10%, что практически совпадает с ВП для первой записи и отличается от нее на
величину, известную как «явление привьпсания» (Кеванишвили З.Ш., 1979; Вагина
М.А., 1994).
Заметим, что уменьшение
амплитуды ВП у разных испытуемых было различным и варьировало от 80 до 0%. При
этом степень подавления ВП зависела от того, до какой максимальной величины
информационной нагрузки удалось вовлечь испытуемого.
Коэффициент корреляции между
уменьшением ВП и степенью информационного воздействия (выраженного в относительных
единицах) составил 0,8 (р < 0,05).
На рис. 20.2 представлена
индивидуальная запись ВП, полученная при информационной загруженности пациента.
Здесь, так же как и на рис. 20.1 (при фармакологическом обезболивании), ВП
отсутствует полностью, хотя механизмы обезболивания в этих двух случаях
различны.
Следует еще раз подчеркнуть,
что ВП, зарегистрированный в ответ на болевое раздражение, может целиком
исчезнуть в случае полной информационной загруженности пациента, что, очевидно,
означает полную потерю болевого ощущения.
Субъективные оценки
испытуемых, полученные в результате опроса после исследований, также
подтверждают это заключение.

Рис. 20.2.
Эффект уменьшения амплитуды болевого ВП при информационном воздействии на
пациента
Таким образом, проведенное
нами исследование показывает, что конкурентное вытеснение ноцицептивной
информации является эффективным методом обезболивания и находит свое воплощение
в различных инструментальных методах немедикаментозной аналгезии.
Рекомендуемая литература:
Булаев В.М. Рецепторы опиатов и их
лиганды //Итоги науки и техники.—1982.—Т. 13.—С. 101—144.
Вальдман А.В., Игнатов Ю.Д. Центральные механизмы боли.—
Л.: Наука, 1976.
Вальдман А.В. Боль как
эмоционально-стрессовая реакция и способы ее антиноцецептивной регуляции //
Вестн. АМН СССР.— 1980—№9. С. 11—17.
Виноградов В.Л. Мониторинг информационной
характеристики ЭЭГ во время общей анестезии // Автореф. дисс. ... канд. мед.
наук.—М., 1996.
Денисенко П.П. Холинергические элементы в
механизме боли и фармакотерапии боли. — В кн.: Фармакологические аспекты
обезболивания.—Л. 1983.—С. 40—43.
Жоров И.С. Общее обезболивание.—М.:
Медицина, 1964.
Кузин М.И., Сачков В.И.,
Сигаев В.В. и др. Теория и практика электроанестезии//Вестн. АМН СССР.—1976.—№ 11.—С.
12—18.
Машковский М.Д, Современные аналгетики
и эндогенные механизмы боли и обезболивания//Вестн. АМН СССР. —1980.— № 9.— С.
52—57.
Мелзак Р. Загадка боли.—М., 1981.
Острейников И.Ф., Пивоваров
С.А., Тамаэян О.В. Изменение гемодинамики и симпатоадреналовой системы во время комбинированной
чрезкожной электростимудяции при малых оперативных вмешательствах у детей //
Анестезиология и реаниматология.—1995. — № 6.—С. 20—22.
Павлов И.П. Полн. собр. соч. 2-е
изд.—М.;Л., 1951.—Кн. 1.— С. 199.
Папин А.А., Петров О.В.,
Вагина М.А., Зетилов В.Б., Какурин Ф.Ф. Влияние различных вариантов премедикации на вызванные
потенциалы головного мозга // Анестезиология и реаниматология.—1982—№ 4—С.
3-4.
Папин А.А., Петров О.В.,
Какурин Ф.Ф., Вагина М.А., Зетилов В.Б. Исследование аналгетического компонента премедикации
методом тепловой сенсометрии // Анестезиология и реаниматология—1983—№ 1.—С.
18—20.
Петров О.В., Вагииа М.А. Энцефалограф: Авторское
свидетельство на изобретение.—№1166788.—1985.
Петров О.В., Вагина М.А. Проблема изучения ЭЭГ при
ЭАУ/ Анестезиология и реаниматология.—1988.—№ 4.—С. 75.
Ревенко С.В., Ермишкин В.В.,
Селектор Л.Я.
Периферические механизмы ноцицепции // Сенсорные системы.—1988.—Т. 2.—№ 2.— С.
198—210.
Сачков В.И., Абрамов Ю.Б.,
Вахрамеев
Л.А., Шарыгина В.Л. О выборе компонентов и средств современной
комбинированной анестезии // Анестезиология и реаниматология.—1980.—№ 4.—С.
3—6.
Хаютин В.М. Механизмы ноцицепции и
антиноцицептивная система ромбовидного мозга // Вестн. АМН СССР.—1980.—№ 9.—
С.26—33.
Хорн Б.К. Моделирование зрения
роботов.—М.: Мир, 1989.
Цибуляк В.Н. Рефлексотерапия в
клинической анестезиологии.— М.: Медицина, 1985.—С. 159.
Шагас Ч. Вызванные потенциалы мозга в
норме и патологии.— М.: Мир,
1975.
Berge O.G., Fasmer О.В., Hole R. Serotonin receptor
antagonists induce hyperalgesia without preventing morphine antinociception. //
Pharmacol. Biochem. Behav., 1983, vol. 19, № 5.—P. 873—878.
Camp W., Martin R., Chapman L.F. Pain
threshold and discrimination of pain intensity during brief exposure to
intense noised/Science.— 1962, vol. 135—P. 788.
Carlin S., Ward W.D., Gershon A., Ingraham R. Sound stimulation and its effect on dental sensation threshold. //
Science. 1962, vol. —P. 1258.
Ghia J.N., Mueller R.A., Duncan G.h. et al.
Serotoninergic activity in man as a function of pain, pain mechanisms and
depression. // Anesth. Analg. 1981, vol. 60, № 12.—P. 854—861.
Frey М. Betrage zur Sinnesphysiologie der Haut. // Ber.
d. Kgl. Sachs. Ges. Wiss., math.-phys. Kl.—1895.—Vol. 47.—P. 181.
Gardner W. J., Licklider J.C.R.
Auditory analgesia in dental operation. //.J. Amer. Dent. Assn. 1959, vol.
59.—P. 1144.
Melzack R., Torgerson W. On the language of
pain. //Anesthesiology. 1971, vol. 34.— P. 50.
Melzack R., Weisz A. Z., Sprague L.T. Stratagems
for controling pain: contributions of auditory Melzackstimulations and
suggestion.// Exper. Neurol. 1963, vol. 8.—P. 3.
Michand J., Ramabardan K., Ronsselle I.C., Jfcjb I. Reactivite nociceptive, sensibilite a la naloxone, dependance aigve et
receptenrs opi-oides chez des souris de differentes souches.//J.
Pharmacol.—1981.— V. 12 —№ l.—P. 83—85.
Sinclair D.C. Cutaneous sensation and the
doctrine of specific energy.//Brain. 1955.—V. 78.—P. 584—614.
Weddell G. Somesthesis and the chemical
senses.//Ann. Rev. Psychol—1955—V. 6—P. 119—136.
СОДЕРЖАНИЕ
Введение
|
3 |
|
Глава
1 Предоперационная подготовка ВВ Лихванцев |
7 |
Осмотр анестезиолога |
7 |
|
Взаимоотношения анестезиолога и хирурга |
16 |
|
Взаимоотношения анестезиолога и больного |
17 |
|
Запись результатов пооперационного осмотра |
|
|
Глава
2 Особенности предоперационного обследования и анестезиологического
обеспечения пациентов с заболеваниями системы дыхания АВ Ситников |
23
|
|
Классификация заболеваний легких |
26 |
|
Общий осмотр анамнеза |
32 |
|
Предоперационное лечение заболеваний системы
дыхания |
34 |
|
Особенности предоперационной подготовки больных
хроническими заболеваниями легких (ХЗЛ) |
35 |
|
Влияние анестезии и операции на функцию легких |
36 |
|
Особенности анестезиологического пособия |
38 |
|
Глава
3 Особенности предоперационного обследования и анестезиологического
обеспечения пациентов с заболеваниями сердечно-сосудистой системы ВВ Субботин |
39 |
|
Ишемическая болезнь сердца |
39 |
|
Приобретенная патология клапанов сердца |
43 |
|
Врожденные пороки сердца |
47 |
|
Особенности предоперационной подготовки у лиц с
имплатированным электрокардиостимулятором или дефибриллятором |
48 |
|
Глава
4 Особенности предоперационного обследования и анестезиологического
обеспечения пациентов с заболеваниями печени ВЛ Виноградов |
62
|
|
Функция печени |
62 |
|
Особенности кровоснабжения печени |
67 |
|
Гепатит |
67 |
|
Предоперационная подготовка |
69 |
|
Особенности анестезиологического пособия у
пациентов с заболеваниями печени |
70 |
|
Нарушение функции печени в послеоперационный период |
72 |
|
Глава
5 Особенности предоперационного обследования и анестезиологического
обеспечения пациентов с заболеваниями мочевыделительной системы НВ Озерова |
73
|
|
Функция почек |
73 |
Почечная недостаточность |
74 |
|
Водно-электролитное состояние и его нарушения |
77 |
|
Действие различных лекарственных препаратов на
почки |
81 |
|
Общие принципы анестезиологического обеспечения
больных с почечной недостаточностью |
85 |
|
Алгоритм действия анестезиолога при нарушении мочеотделения |
88 |
|
Глава
6 Анестезиологическое оборудование ВВ Субботин |
89 |
|
Наркозно-дыхательный аппарат |
89 |
|
Набор для пункции и катетеризации |
93 |
|
Набор для обеспечения проходимости дыхательных
путей и интубации трахеи |
94 |
|
Минимальный набор лекарственных препаратов |
95 |
|
Подготовка операционной к работе |
96 |
|
Глава
7 Пункционная катетеризация вен ВЛ Виноградов |
98
|
Общие положения |
98 |
|
Катетеризация периферических вен |
98 |
Катетеризация центральных вен |
99 |
|
Глава
8 Обеспечение проходимости дыхательных путей АВ Ситников |
106 |
|
Анатомия (некоторые особенности) |
106 |
|
Функции |
107 |
|
Иннервация |
107 |
|
Оценка состояния дыхательных путей |
107 |
|
Основные виды вентиляции |
111 |
|
Некоторые осложнения, связанные с обеспечением
проходимости дыхательных путей |
124 |
|
Роль региональной анестезии |
127 |
|
Глава
9 Мониторинг ВВ Лихванцев |
128 |
|
Стандарты мониторинга |
128 |
|
Мониторинг состояния сердечно-сосудистой системы |
129 |
|
Мониторинг дыхания |
137 |
|
Термометрия |
143 |
|
Глава
10 Общая анестезия ВВ Лихванцев |
145 |
|
Глава
11 Многокомпонентная анестезия на основе в/в препаратов А И Салтанов |
149 |
Гипнотики
|
150 |
|
Аналгетики |
160 |
|
Нейровегетативная защита |
160 |
|
Глава
12 Общая ингаляционная анестезия ВВ Лихванцев |
174
|
Механизм действия |
175 |
|
Фармакокинетика |
175 |
|
Фармакодинамика |
175 |
|
Методики анестезии |
177 |
|
Закись азота |
178 |
|
Глава
13 Мышечные релаксанты АУ Лекманов |
179
|
|
Нервномышечное проведение |
174 |
|
Классификация мышечных релаксантов |
181 |
|
Особенности действия деполяризующих мышечных
релаксантов |
184 |
|
Особенности действия недеполяризующих мышечных
релаксантов |
185 |
|
Характеристика недеполяризующих мышечных
релаксантов |
186 |
|
Мониторинг мышечной релаксации |
190 |
|
Глава
14 Интрооперационная органопротекция В.В.Лихванцев |
193 |
|
Общая гипотермия |
193 |
|
Фармакологическая
органопротекция |
195 |
|
Глава
15 Принципы проведения общей анестезии ВВ Лихванцев |
197 |
|
Предоперационная подготовка |
197 |
|
Подготовка пациента в операционной |
198 |
|
Вводный наркоз |
199 |
|
Поддержание анестезии |
201 |
|
Вентиляция |
203 |
|
Период пробуждения |
204 |
|
Перевод в ПИТ |
206 |
|
Глава
16 Эпидемиология анестезии ВВ Лихванцев |
207 |
|
Общие правила
безопасности |
209 |
|
Протоколы и стандарты |
209 |
|
Действия врача-анестезиолога при возникновении
серьезного осложнения |
212 |
|
Глава
17 Возможные осложнения и их терапия АВ Ситников |
214 |
|
Интраоперационный контроль гемодинамики |
214 |
|
Интраоперационные нарушения жизненно важных функций |
226 |
|
Глава
18 Интраоперационная инфузионно-трансфузионная терапия АВ Ситников |
233 |
|
Показания к трансфузионной терапии |
233 |
|
Терапия компонентами крови |
235 |
|
Осложнения гемотрансфузии |
238 |
|
Принципы инфузионной терапии |
239 |
|
Глава
19 Мониторинг глубины общей анестезии ВЛ Виноградов |
243 |
|
Концепция мониторинга глубины анестезии |
245 |
|
Методы контроля глубины анестезии |
246 |
|
Глава
20 Краткие сведения о механизме боли и обезболивания ОВ Петров |
263 |
Немедикаментозные методы обезболивания |
266 |
|
Информационная концепция боли и обезболивания |
268 |
ПРАКТИЧЕСКОЕ РУКОВОДСТВО ПО
АНЕСТЕЗИОЛОГИИ
Под ред. В.В. Лихванцева
Отв. за выпуск Пучкова
Е.А.
Редактор Сологуб Т.Л.
Корректор Голубева И.Н.
Компьютерная верстка Голубев
В.В.
Изд. лиц. № 064889 от
24.12.96
Подписано в печать 02.03.98.
Формат 84х108 1/32
Печать офсетная. Бумага
офсетная. Гарнитура Times. Объем 9,0 печ. л.
Тираж 10 000 экз. Заказ № 124
ООО «Медицинское
информационное агентство»,
119435 Москва, М. Трубецкая
ул., д. 8
(ММА им. И.М.
Сеченова), тел./факс 245-86-20, 242-91-10
Отпечатано с готового
оригинал-макета в типографии ИПО «Полигран»
125438. Москва, Пакгаузное
шоссе, 1
ISBN 5-89481-022-1
Fresenius
Фирма «FRESENIUS AG» постоянно предлагает со
своего склада в Москве и производит отгрузку по России высококачественные
инфузионные растворы для полноценного парентерального питания детей и взрослых
собственного производства:
— растворы аминокислот
общего (Аминостерил КЕ 10%) и специального (Аминостерил КЕ Нефро,
Аминостерил N-Гепа 5%) назначения, а также для новорожденных и детей до 6 лет
(Аминовеноз пед);
— жирорастворимые эмульсии
(Липовеноз 10% и 20%);
— Углеводные растворы
(Глюкостерил 10% и 20%),
а также для лечения
гиповолемии и шока:
— идеальный коллоидный
плазмозамещающий раствор на основе гидроксиэтилкрахмала (HES200/0,5),
позволяющий реально сократить расходы клиники на альбумин, плазму и цельную
кровь (ХАЕС-стерил 6% и 10%);
— корректор электролитного
баланса (Иностерил).
Представительство фирмы
«Фрезениус АГ» в Российской Федерации
ЗАО «ФРЕЗЕНИУС СП»: 117630,
Москва, а/я 16. Тел.: (095) 936-23-42(43), факс:
(095) 234-01-55
Hoechst Marion Roussel
Hoechst
Москва, ул. Вятская, л.
70. Тел.: 232-14-25
Сегодня — самый эффективный,
безопасный и быстродействующий кортикостероид в интенсивной терапии
Целестон® для инъекций
Стерильный раствор натриевой
соли бетаметазона фосфата. В 1 мл препарата содержится 5,3 мг натриевой соли
бетаметазона фосфата, что эквивалентно 4 мг бетаметазона.
|
|
Ампулы по 1 мл в упаковке №
1
Основные показания:
Шок Отек мозга
Аллергические состояния
Респираторные заболевания Профилактика дистресс-синдрома недоношенных
Профилактика отторжения почечного трансплантата Заболевания соединительной
ткани Желудочно-кишечные заболевания Гематологические заболевания
|
|
Шеринг-Плау/США
Адрес представительства:
121069, Москва, Хлебный пер., 19. Тел.: (095) 291-52-70, 291-74-30, факс
(095) 291-50-60



|
|